微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (下表是元素周期表的一部分,请回答有关问题:
主族
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0
2
①
②
③
3
④
⑤
⑥
⑦
⑧
4
⑨
⑩
|
(1)表中化学性质最不活泼的元素,其原子结构示意图为______
(2)表中能形成两性氢氧化物的元素是______?(用元素符号表示),写出该两性氢氧化物与⑦的氢化物的水溶液反应的离子方程式______.
(3)④元素与⑦元素形成的化合物的电子式为______.
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是______(填酸的化学式)
(5)③元素与⑩元素两者核电荷数之差是______.
(6)④⑤两元素相比较,金属性较强的是______(填名称),可以验证该结论的实验是______(填编号).
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
(c)将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性.
参考答案:由元素在周期表中的位置可知,①为C,②为N,③为F,④为Mg,⑤为Al,⑥为S,⑦为Cl,⑧为Ar,⑨为K,⑩为Br,
(1)Ar的最外层电子数为8,为稳定结构,则化学性质不活泼,其原子结构示意图为
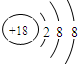
,故答案为:
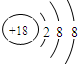
;
(2)上述元素中只有Al的氢氧化物为两性,氢氧化铝与HCl反应生成氯化铝和水,
其离子反应为Al(OH)?3+3H+═Al3++3H2O,故答案为:Al;Al(OH)?3+3H+═Al3++3H2O;
(3)氯化镁为离子化合物,其电子式为
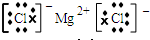
,故答案为:
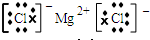
;
(4)非金属性越强,则元素的最高价氧化物的水化物中酸性越强,Cl、S、N、C中非金属性最强的为Cl,其最高价氧化物的水化物为HClO4,故答案为:HClO4;?
(5)F的核电荷数为9,Br的核电荷数为35,则35-9=26,故答案为:26;?
(6)同周期元素从左到右金属性在减弱,则金属性Mg>Al,可利用金属单质与水、酸或最高价氧化物对应水化物的碱性来比较金属性,则b、c可以,故答案为:镁;b、c.
本题解析:
本题难度:简单
2、选择题 有关化学用语正确的是
[? ]
A.乙炔的最简式C2H2
B.NH3、H2O、CO2、HCl分子中CO2孤电子对最多
C.水的电子式 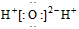
D.硝酸钾的化学式 KNO3
参考答案:D
本题解析:
本题难度:简单
3、选择题 如果两个电子自旋方向相反的氢原子互相靠近时,两个原子轨道则发生重叠,当核间距为74pm时,两个原子轨道发生最大程度的重叠,此时体系的能量最低。下图表示两个气态基态氢原子相互接近形成氢气分子时,体系能量随两个原子的核间距离变化的曲线图,下列关于氢原子形成氢分子说法不正确的有
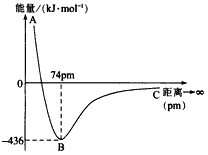
[? ]
A.氢分子比氢原子稳定
B.氢原子的半径约为37pm
C.形成一个H-H键吸收436kJ能量
D.当核间距接近74pm时,形成了氢分子中s~s σ键
参考答案:C
本题解析:
本题难度:一般
4、选择题 下列物质中,含有共价键的离子化合物是( ? )
A.H2SO4
B.MgCl2
C.Na2O
D.NaOH
参考答案:D
本题解析:
本题难度:简单
5、选择题 近年用红外激光技术研究液氢,发现范德华力也可以引起微粒间反应,已知在液氢中有氢分子和质子形成的H3+离子,其构型为等边三角型,属于二电子三中心离子.同时H3+?和氢分子可进一步形成Hn+有关判断正确的是( )
A.H3+的电子式为?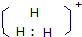
B.H3+可进行反应,在液态氢中形成H4+、H6+、H9+
C.H3+可在液态氢中形成H5+、H7+、H9+
D.H3+广泛存在于固态、液态和气态氢中
参考答案:C
本题解析:
本题难度:一般