微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在冶金工业上,均不能用通常化学还原剂制得的金属组是? ( )。
A.Na,Ba,Mg,Al
B.Na,K,Zn,Fe
C.Zn,Fe,Cu,Ag
D.Mg,Al,Zn,Fe
参考答案:A
本题解析:金属的冶炼方法,根据金属的活动性归纳如下:
方法名称 冶炼的金属 举例
电解法:? K~Al? 2Al2O3 4Al+3O2↑
4Al+3O2↑
还原剂法:? Zn~Cu? 2Al+Fe2O3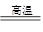 ?2Fe+Al2O3
?2Fe+Al2O3
加热法? Hg、Ag? HgS+O2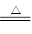 ?Hg+SO2
?Hg+SO2
因为活泼金属的阳离子氧化性很弱,一般还原剂难以将它还原为金属,所以采用电解法,不活泼金属的阳离子氧化性强,加热时可从化合物内部得电子被还原成单质,所以可用加热法。
本题难度:一般
2、选择题 下列不属于硅酸盐工业产品的是
[? ]
A.水泥
B.玻璃
C.陶瓷
D.化肥
参考答案:D
本题解析:
本题难度:简单
3、填空题 (12分)海水是取之不尽用之不竭的化学资源,从海水中可提取多种化工原料,下图是某化工厂对海水资源综合利用的示意图。
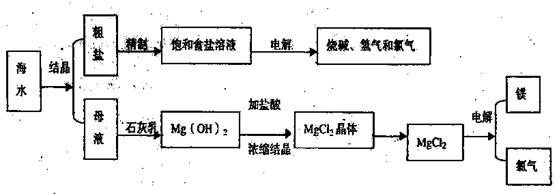
回答下列问题:
(1)请写出电解食盐水的离子方程式?。
(2)母液中含有K+、Na+、Mg2+等阳离子,从图中可看出对母液进行一系列的加工可制得金属镁。
①从离子反应的角度思考,在母液中加入石灰乳所起的作用是:?。
②石灰乳是生石灰与水作用形成的化合物,从充分利用当地海洋化学资源,提高生产与经济效益的角度考虑,生产生石灰的主要原料是?;
③电解熔融氯化镁的化学方程式是?;
④电解无水氯化镁所得的镁蒸气在特定的环境里冷却后可得固态的金属镁,下列物质中可用作镁蒸气的冷却剂是(填写代号)?。
A.H2? B.Cl2? C.空气? D.O2
E.水蒸气
(3)在该化工厂中,海水提取氯化钠后的母液经过提取氯化镁后又形成了新的母液,向新母液中加入一种常见的气态氧化剂,又制取了重要的化工原料溴单质:
①生成溴单质的化学反应的离子方程式是?
②以下是对生产溴单质所用的气态氧化剂寻找货源的主凤想,其中合理的是?
(填写代号)
A.以外地购买? B.在当地新建生产厂
C.从本厂生产烧碱外循环? D.从木厂生产镁单质处循环
③从各种经营综合开发,打造大而强的现代企业以及本厂生产所需要的原料等方面来看,你认为该化工厂还可以再增加的生产项目是?。
参考答案:
(1)2Cl-+2H2O
(2)①使Mg2+转化为Mg(OH)2↓或Mg2++20H-=Mg(OH)2↓(1分)
②贝壳(石灰石)(1分)?③MgCl2(熔融)
④A(2分)
(3)C12+2Br-=Br2+2C1-?(2分)? C、D?(2分)?生产盐酸(1分)
本题解析:略
本题难度:简单
4、实验题 从海水提取镁和溴的流程如下,请回答相关问题。
(1)从海水中提取镁的流程如下图所示(框图中是主要产物):
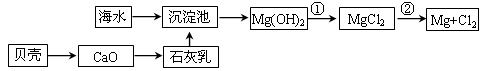
i.海水进入沉淀池前,对海水进行处理有以下两种方案:
方案一:将晒盐后的卤水通入沉淀池;
方案二:将加热蒸发浓缩后的海水通入沉淀池。
你认为方案________更合理,理由是_________________________________________。
ii.反应①的离子方程是________________________________________________。
反应②的化学方程式是_______________________________________________。
(2)从海水中提取溴的流程如下图所示(框图中是主要产物):
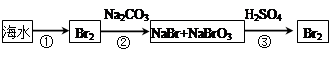

i.过程①中,加入的试剂是___________。
ii.过程②中,向混合液中吹入热空气,将溴吹出,用纯碱吸收,吹入热空气的目的是______________________________________________________________________。
iii.过程③中反应的化学方程式是____________________________________________。
iv.若最终得到的溴单质中仍然混有少量的Cl2,则除去该杂质的方法是__________________________________________________(结合离子方程式回答)。
参考答案:(9分)(1)i. 一?要加热海水需大量的能源,浪费了能源
ii. Mg(OH)2+2H+=Mg2++2H2O ; MgCl2(熔融) Mg+Cl2↑
Mg+Cl2↑
(2)i.? Cl2
ii.温度升高,气体的溶解度减小,另外空气不与溴发生反应,可以搅动液体,有利于溴蒸汽的逸出
iii.5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O(2分)
iv.加入适量溴化钠,利用有机溶剂将溴分离提纯,Cl2+2Br-=Br2+2Cl-
本题解析:(1)i.由于蒸发浓缩海水需要加热海水,从而消耗大量的能源,浪费了能源,所以方案一最好。
ii.氢氧化镁转化为氯化镁,需要将氢氧化镁溶解在盐酸中,反应的离子方程式是Mg(OH)2+2H+=Mg2++2H2O;镁是活泼的金属,需要电解法冶炼,电解熔融的氯化镁即可生成金属镁和氯气,反应的化学方程式是MgCl2(熔融) Mg+Cl2↑。
Mg+Cl2↑。
(2)i.海水中的溴是以溴离子的形成存在的,需要加入氧化剂将其氧化生成单质溴,因此过程①中,加入的试剂是Cl2。
ii.由于温度升高,气体的溶解度减小,另外空气不与溴发生反应,可以搅动液体,有利于溴蒸汽的逸出,因此要吹入热空气。
iii.在酸性条件下,溴酸钠能和溴化钠发生氧化还原反应生成单质溴,反应的化学方程式是5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O。
iv. 氯气具有强氧化性,所以要出去单质溴中的少量氯气,可以加入适量溴化钠,利用有机溶剂将溴分离提纯,反应的离子方程式是Cl2+2Br-=Br2+2Cl-。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。该题以海水的综合应用为载体,有利于调动学生的学习兴趣,激发学生的学习求知欲。
本题难度:一般
5、选择题 在冶金工业上,均不能用化学还原剂制得的一组金属是
A.Na Mg Al
B.Na K Zn Fe
C.Zn Fe Cu Ag
D.Mg Al Zn Fe
参考答案:A
本题解析:A、Na、Mg、Al均是活泼的金属,不能通过还原剂还原得到,只能通过电解法冶炼,A正确;B、锌和铁均可以通过还原剂还原得到,B不正确;C、Zn、Fe、Cu均可以通过还原剂还原得到,Ag是不活泼的金属,可以通过热分解得到,C不正确;D、锌和铁均可以通过还原剂还原得到,D不正确,答案选A。
本题难度:一般