微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (5分)海水是一种重要的自然资源。以下是我市对海水资源的部分利用。
(1)从海水中获得氯化钠。将海水进行?可得到粗盐;为除去粗盐中含有的SO42-、Ca2+、Mg2+等杂质,有如下操作:①溶解;②加过量的Na2CO3溶液; ③加过量的BaCl2溶液;④加适量的盐酸;⑤加过量NaOH溶液;⑥蒸发结晶;⑦过滤。正确的操作顺序是_________________。(用序号填一种合理组合)。
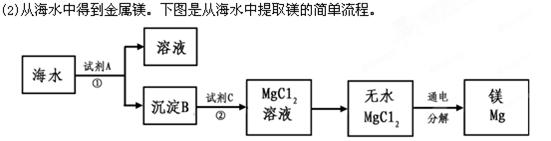 上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为__________,
上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为__________,
由无水MgCl2制取Mg的化学方程式为_____________________________________。海
水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同:___________________________________________________________。
参考答案:蒸发结晶? ①③②⑤⑦④⑥(或①⑤③②⑦④⑥或①③⑤②⑦④⑥)
(3) Mg(OH)2?MgCl2通电?Mg+Cl2↑?后者是经过富集和分离后的溶液(或海水中含有氯化钠等多种溶质,氯化镁的浓度很低)
本题解析:略
本题难度:一般
2、选择题 下列说法中不正确的是( )。
A.金属的冶炼原理,就是运用氧化还原反应原理,在一定条件下将金属从其化合物中还原出来
B.冶炼金属时,必须加入一种物质作还原剂
C.金属由化合态变为游离态,一定是被还原
D.金属单质被发现和应用的越早,其活动性越弱
参考答案:B
本题解析:金属的冶炼就是把金属从其化合物中还原出来;有些金属冶炼时不需要还原剂,例如:Hg和Ag的冶炼,工业上用热分解法使HgO和Ag2O分解来获得Hg和Ag;金属在化合态中显正价,变成游离态化合价降低,被还原;金属活动性越弱,金属的获取越容易,金属单质被发现和应用的越早。
本题难度:一般
3、填空题 (12分)双氧水、过硫酸钾是工业上常用的氧化剂、消毒剂。工业上以铂为阳极,铅或石墨为阴极,电解NH4HSO4溶液得过硫酸铵【(NH4)2S2O8】溶液,其工艺流程为:

(1)将电解后的溶液送往水解器中在减压条件下水解、蒸馏、浓缩分离,精馏得过氧化氢的水溶液,剩余溶液再循环使用。
①写出电解NH4HSO4溶液的化学方程式???
②写出水解器中(NH4)2S2O8溶液的水解方程式???。
③铂价格昂贵,试分析电槽阳极用铂不用铅的原因???。
④试分析水解器中使用减压水解、蒸馏的原因???。
(2)在电解后的过硫酸铵溶液中加入硫酸氢钾,析出过硫酸钾固体,过硫酸钾具有强氧化性,常被还原为硫酸钾,80℃以上易发生分解。
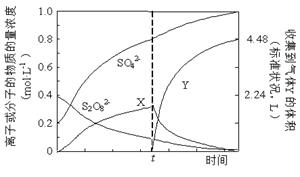
①将0.40 mol过硫酸钾与0.20 mol硫酸配制成1 L溶液,在80 ℃条件下加热并在t时刻向溶液中滴加入少量FeCl3溶液,测定溶液中各成分的浓度如右图所示(H+浓度未画出)。图中物质X的化学式为???。
②已知硫酸锰(MnSO4)和过硫酸钾(K2S2O7)两种盐溶液在银离子催化下可发生反应,得到紫红色溶液。此反应的离子反应方程式???.
参考答案:(1)①2NH4HSO4 (NH4)2S2O8+H2(2分)
(NH4)2S2O8+H2(2分)
②(NH4)2S2O8+2H2O = 2NH4HSO4+H2O2(2分
③铅会在阳极失电子生成阳离子进入溶液,且在阳极生成的S2O82-会氧化铅(2分)
④减压水解、蒸馏是为了减少双氧水的分解损失。(2分)
(2)①H2O2?(2分)
②2Mn2++5S2O82-+8H2O?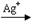 ?2MnO4-+10SO42-+16H+(2分)
?2MnO4-+10SO42-+16H+(2分)
本题解析:(1)电解和水解的反应式均可根据题中所给反应物和生成物书写,可得①2NH4HSO4 (NH4)2S2O8+H2,②(NH4)2S2O8+2H2O = 2NH4HSO4+H2O2。③使用铂的原因是,铅会在阳极失电子生成阳离子进入溶液,且在阳极生成的S2O82-会氧化铅。④减压水解、蒸馏是为了减少双氧水的分解损失。(2)①刚开始,S2O82-发生反应,产生H2O2 ,而H2O2 易分解,滴入少量FeCl3溶液,即是滴入了催化剂,加快了H2O2 的分解,故在t时含量迅速降低。故物质X就是H2O2 。②得到紫红色溶液,即有高锰酸根生成,故反应离子式为2Mn2++5S2O82-+8H2O?
(NH4)2S2O8+H2,②(NH4)2S2O8+2H2O = 2NH4HSO4+H2O2。③使用铂的原因是,铅会在阳极失电子生成阳离子进入溶液,且在阳极生成的S2O82-会氧化铅。④减压水解、蒸馏是为了减少双氧水的分解损失。(2)①刚开始,S2O82-发生反应,产生H2O2 ,而H2O2 易分解,滴入少量FeCl3溶液,即是滴入了催化剂,加快了H2O2 的分解,故在t时含量迅速降低。故物质X就是H2O2 。②得到紫红色溶液,即有高锰酸根生成,故反应离子式为2Mn2++5S2O82-+8H2O? ?2MnO4-+10SO42-+16H+
?2MnO4-+10SO42-+16H+
点评:本题属于常规工艺流程题,需要利用化学反应原理对生产工艺进行分析,其中涉及的化学原理都是常见化学物质的性质,接下来的小题会涉及不同的知识点来解答,要利用到物质的特殊化学性质,学生应当对这部分知识熟练掌握,最后的图像题,还是将图像信息转化为化学的文字信息来理解。
本题难度:困难
4、选择题 下列物质有固定熔点的是
[? ]
A.水泥
B.玻璃
C.Na2O·SiO2
D.水玻璃
参考答案:C
本题解析:
本题难度:简单
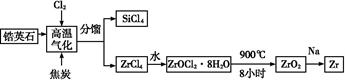
5、填空题 锆产业是极有发展潜力及前景的新兴产业,锆(Zr)元素是核反应堆燃料棒的包裹材料,二氧化锆(ZrO2)可以制造耐高温纳米陶瓷。我国有丰富的锆英石(ZrSiO4),含Al2O3、SiO2、Fe2O3等杂质,生产锆流程之一如下:
试回答下列问题:
(1)写出上述流程中高温气化的反应方程式(碳转化成CO):?;
(2)写出ZrOCl2·8H2O在900 ℃生成ZrO2的反应方程式 ?;
(3)关于二氧化锆纳米陶瓷和锆合金的说法不正确的是 (单选)。
A.二氧化锆纳米陶瓷是新型无机非金属材料
B.1纳米=10-10米
C.锆合金的硬度比纯锆要高
D.日本福岛核电站的爆炸可能是由锆合金在高温下与水蒸气反应产生的氢气爆炸引起
参考答案:(1)4C+4Cl2+ZrSiO4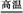 ZrCl4+SiCl4+4CO
ZrCl4+SiCl4+4CO
(2)ZrOCl2·8H2O ZrO2+2HCl↑+7H2O↑
ZrO2+2HCl↑+7H2O↑
(3)B
本题解析:(1)结合流程图中物质知锆英石(ZrSiO4)、C、Cl2制得ZrCl4、SiCl4、CO,在结合化合价升降总数相等配平该方程式。
(2)ZrOCl2·8H2O到ZrO2化合价不发生改变,Zr需结合水中的O,剩余H与Cl结合生成HCl。
(3)1纳米=10-9米,B项错误。
本题难度:一般