微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分) (1)新制备的氯水显__________色,说明氯水中有__________(填分子式)分子存在。
(2)向氯水中滴加几滴AgNO3溶液,立即有__________生成,说明氯水中有__________(填化学式)存在,反应的化学方程式为_____________?_____________。
(3)氯水光照后颜色变浅,并放出___?_____色的气体。
参考答案:(12分)黄绿? Cl2?(2)白色沉淀? HCl? HCl +AgNO3= AgCl↓+HNO3 (3)无
本题解析:略
本题难度:简单
2、选择题 下列说法中错误的是
A.从1 L 1 mol·L-1的NaCl溶液中取出10 mL,其浓度仍是1 mol·L-1
B.制成0.5 L 1 mol·L-1的盐酸,需要氯化氢气体11.2 L(标准状况)
C.0.5 L 2mol·L-1BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D.配制2.0 mol/L的盐酸时,将量取的浓盐酸放入容量瓶中加水稀释
参考答案:D
本题解析:略
本题难度:简单
3、实验题 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中?有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),完成下列问题。
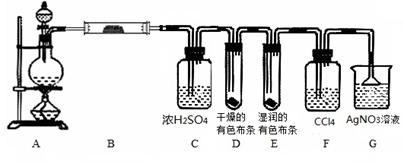
(1)用 MnO2和浓盐酸混合共热制得氯气的化学方程式是____?____。
(2)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积在标准状况下总是小于1.12 L的原因是_____________________________________________。
(3)①装置B的作用是____________________________________________________,
装置B中的现象是____________________________。
②装置D和E出现的不同现象说明的问题是_____________________________。
③装置F的作用是________________________。
④装置G中发生反应的化学方程式为?。
参考答案:(1)MnO2+4HCl 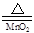 MnCl2+Cl2↑+2H2O?(2) 浓盐酸的浓度随着反应的进行降低到一定数值以后,将不再反应;加热时浓盐酸因挥发而损失。(3)①检验有水蒸气产生?无水硫酸铜变为蓝色
MnCl2+Cl2↑+2H2O?(2) 浓盐酸的浓度随着反应的进行降低到一定数值以后,将不再反应;加热时浓盐酸因挥发而损失。(3)①检验有水蒸气产生?无水硫酸铜变为蓝色
②干燥的氯气无漂白性,潮湿的氯气(或次氯酸)有漂白性?③吸收氯气?④HCl+AgNO3=AgCl↓+HNO3
本题解析:(1)在实验室是用MnO2和浓盐酸混合共热制得氯气的。化学方程式是MnO2+4HCl 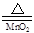 MnCl2+Cl2↑+2H2O(2)MnO2只和浓盐酸反应,但随着反应的进行,盐酸的浓度减小,当降低到一定程度时就不再发生反应。此外浓盐酸有挥发性,加热使盐酸因挥发而损失降低。所以放出的气体小于理论值1.12 L(3)①装置B的作用是用无水硫酸铜来检验氯气中水蒸气的存在。②干燥的氯气没有漂白性,当氯气中含有水蒸气时二者发生反应产生盐酸和次氯酸。次氯酸有漂白性。即潮湿的氯气(或次氯酸)有漂白性。③卤素单质容易溶解在有机溶剂中,而不容易溶解在水中。氯化氢则溶液溶解在水中,不易溶解在有机溶剂中。利用它们溶解性的不同,用四氯化碳来溶解吸收氯气。④HCl和AgNO3反应的化学方程式为:HCl+AgNO3=AgCl↓+HNO3
MnCl2+Cl2↑+2H2O(2)MnO2只和浓盐酸反应,但随着反应的进行,盐酸的浓度减小,当降低到一定程度时就不再发生反应。此外浓盐酸有挥发性,加热使盐酸因挥发而损失降低。所以放出的气体小于理论值1.12 L(3)①装置B的作用是用无水硫酸铜来检验氯气中水蒸气的存在。②干燥的氯气没有漂白性,当氯气中含有水蒸气时二者发生反应产生盐酸和次氯酸。次氯酸有漂白性。即潮湿的氯气(或次氯酸)有漂白性。③卤素单质容易溶解在有机溶剂中,而不容易溶解在水中。氯化氢则溶液溶解在水中,不易溶解在有机溶剂中。利用它们溶解性的不同,用四氯化碳来溶解吸收氯气。④HCl和AgNO3反应的化学方程式为:HCl+AgNO3=AgCl↓+HNO3
本题难度:一般
4、选择题 某同学用下列装置制备并检验Cl2的性质.
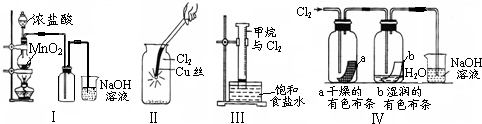
下列说法正确的是( )
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗完
B.Ⅱ图中:生成蓝色的烟
C.Ⅲ图中:量筒中发生了加成反应
D.Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
参考答案:A.二氧化锰和浓盐酸在加热条件下发生氧化还原反应生成氯气,但稀盐酸与二氧化锰不反应,当盐酸浓度降低时,反应停止,则盐酸不能完全消耗,故A错误;
B.氯气与铜反应生成棕黄色的烟,加水溶液呈蓝色,故B错误;
C.氯气和甲烷在光照下发生取代反应,故C错误;
D.氯气与水反应生成具有漂白性的HClO,湿润的有色布条能褪色,与NaOH反应生成NaCl和NaClO,二者在酸性条件下反应生成氯气,故D正确.
故选D.
本题解析:
本题难度:简单
5、选择题 下列关于氯气的叙述,正确的是 (?)
A.氯气是一种无色,没有刺激性气味的气体
B.氯气、氯水、液氯的成分相同
C.氯气不能与水发生反应
D.氯气有毒,但可用来杀菌消毒
参考答案:D
本题解析:略
本题难度:简单