理由
①
②
参考答案:(Ⅰ)A、工业制备玻璃是利用石英石灰石、纯碱在高温下加热发生复杂物理化学反应得到,故A正确;
B、工业合成氨是气体体积减小的反应,增大压强平衡正向进行,氨气产率增大,但压强增大会提高设备耐压能力,材料要求高,增大投资减小经济效益,故B正确;
C、暂时硬水是由碳酸氢钙和碳酸氢镁引起,加热酸式盐会分解沉淀钙离子和镁离子,起到软化水的目的,永久硬度是钙、镁离子的硫酸盐、硝酸盐等,加热不能使钙离子和镁离子沉淀,所以加热法只适用于软化暂时硬度的硬水,故C正确;
D、氯化铝是共价化合物,熔融无阴阳离子存在,工业上是利用电解熔融氧化铝制备,故D错误;
E、碳和石英高温反应生成的为粗硅,故E错误;
故答案为:ABC;
(II)(1)分析题中图可以知道,图②表示N2、H2被吸附在催化剂表面,而图③表示在催化剂表面,N2、H2中化学键断裂;
故答案为:N2、H2被吸附在催化剂表面;在催化剂表面,N2、H2中化学键断裂;
(2)化氧化设备中设置热交换器,把不同温度之间的气体进行热交换,可预热反应气体,余热利用可起到充分利用能源的目的;合成硝酸的吸收塔中通入空气的目的是利用一氧化氮和氧气按照4:3全部反应生成硝酸;4NO+3O2+2H2O=4HNO3,可使NO循环利用,全部转化成HNO3;
故答案为:利用余热,节约能源;可使NO循环利用,全部转化成HNO3;
(3)碱液吸收法:NO+NO2+2NaOH═2NaNO2+H2O,NH3还原法:8NH3+6NO2催化剂.△7N2+12H2O,分析可知碱液吸收法消耗大量的氢氧化钠生成的亚硝酸盐有毒,NH3还原法产物无污染,得到合成氨的原料气;
故答案为:碱液吸收法要消耗大量的NaOH,同时产生有毒的NaNO2.NH3还原法不消耗贵重原料,且产物无污染,N2又可做合成NH3的原料气;
(4)由NH3制NO的产率是96%、NO制HNO3的产率是92%,
根据氮原子守恒可知,
NH3~NO~HNO3,
则1mol氨气可得到硝酸1mol×96%×92%=0.8832mol,
由HNO3+NH3═NH4NO3,
则该反应消耗的氨气的物质的量为0.8832mol,
氨气的质量之比等于物质的量之比,
则制HNO3所用去的NH3的质量占总耗NH3质量的百分数为1mol1mol+0.8832mol×100%=53%;
故答案为:53;
(5)由于硝酸铵受撞击时易爆炸,因此硝酸铵不能与易燃物混放;不能用铁锤等物将结块的硝酸铵砸碎;不能受到严重撞击,NH4NO3撞击.N2O↑+2H2O;铵盐水解显酸性不能和水解显碱性的草木灰混合使用,硝酸铵是易溶于水的物质易在土壤中流失;
①不能与碱性肥料混施硝酸铵溶液呈碱性;
②不能剧烈撞击硝酸铵易爆炸;
③不能在雨水较多的地区使用硝酸铵吸水性强,易流失;
故答案为:①不能与碱性肥料混施硝酸铵溶液呈碱性;
②不能剧烈撞击硝酸铵易爆炸;
③不能在雨水较多的地区使用硝酸铵吸水性强,易流失;
本题解析:
本题难度:简单
2、选择题 如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是
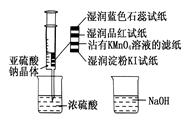
A.蓝色石蕊试纸先变红后褪色
B.品红试纸、沾有KMnO4溶液的滤纸均褪色证明了SO2具有漂白性
C.湿润淀粉KI试纸变蓝说明SO2的氧化性弱于I2
D.NaOH溶液可用于除去实验中多余的SO2
参考答案:D
本题解析:略
本题难度:一般
3、选择题 下列实验操作的先后顺序合理的是(?)
A.制取乙酸乙酯,应先将乙醇、乙酸混合,后加入到浓硫酸中
B.酸碱中和滴定中,应先将锥形瓶用待测液润洗,后加入一定体积的待测液
C.配制SnCl2溶液时,应先将SnCl2固体溶于浓盐酸中,后加水稀释
D.用分液漏斗滴液,应先旋开分液漏斗的活塞,后打开漏斗上口的玻璃塞
参考答案:C
本题解析:在C中,由于SnCl2易水解生成Sn(OH)2和HCl,故配制时常将其溶于浓HCl中,以防止其发生水解,故C选项正确。
本题难度:一般
4、实验题 化学活动课上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性良好).观察现象,回答下列问题:
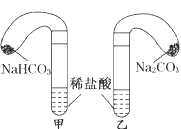
(1)各组反应开始时,________装置中的气球体积先变大,原因是___________________,该装置中反应的离子方程式是___________________________________________。
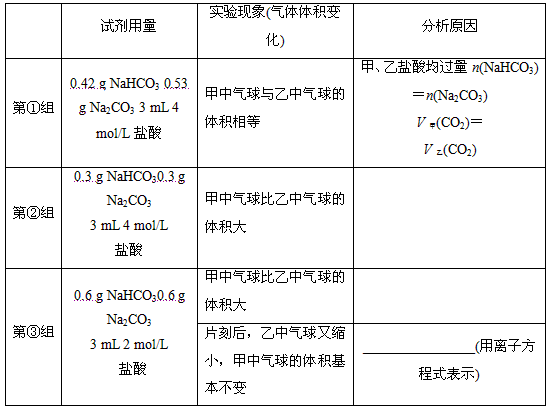
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格。
参考答案: (1)甲因为NaHCO3与盐酸反应的速率大于Na2CO3与盐酸反应的速率 ;HCO3-+H+===H2O+CO2↑
(2)第②组:甲、乙盐酸均过量,n(NaHCO3)>n(Na2CO3),V甲(CO2)>V乙(CO2)
第③组:NaHCO3和Na2CO3均过量,以盐酸为准求产生气体的量,HCO3-~H+~CO2↑,
CO32-~2H+~CO2↑,V甲(CO2)>V乙(CO2) CO+CO2+H2O===2HCO3-
本题解析:
本题难度:一般
5、实验题 稀盐酸可以使紫色石蕊试液变红。我们已经知道,在稀盐酸中主要存在有H2O、Cl-和H+等粒子。请你设计几个简单实验,探究可能是稀盐酸中的哪一种粒子使石蕊试液变红。(写出简单的实验步骤、观察到的现象以及由此得到的结论)
____________________________________
参考答案:方法一:向一支盛有蒸馏水的试管中,滴加数滴紫色石蕊试液,试液呈紫色,将此试液分装在两个试管中,向其中分别加入少量稀盐酸及稀硫酸,两支试管中的溶液均变红,说明可能是H+使石蕊试液变红。
方法二:用两支试管分别取少量蒸馏水和氯化钠溶液,各滴加数滴紫色石蕊试液,均不变红,说明H2O和Cl-均不能使石蕊试液变红,说明可能是盐酸中的H+使石蕊试液变红。
方法三:取少量稀盐酸于试管中,滴加数滴紫色石蕊试液,溶液变红。逐滴加入NaOH溶液,试管中的溶液由红色变紫,最后变成蓝色。在反应后的溶液中H2O和Cl-仍然存在,而H+被反应生成了H2O,说明
H2O和Cl-都不能使石蕊变红,是稀盐酸中的H+使石蕊试液变红。
(答案合理即可)
本题解析:
本题难度:一般
|