微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列对实验现象的预测或解释正确的是
A.向品红溶液中通入某无色气体,品红溶液退色,则该气体一定是二氧化硫
B.向血红色的硫氰化铁溶液中通入碘化氢气体,溶液不退色
C.向含酚酞的红色氢氧化钠溶液中通入无色的臭氧气体,红色可能退去
D.向碘化银的悬浊液中加入少量氯化银,并用力振荡,黄色变浅
参考答案:C
本题解析:A项中若通入臭氧,臭氧具有强氧化性,将品红氧化为无色物质,A错;碘化氢具有较强的还原性,可以将三价铁离子还原为2价,血红色退去,故B项错误;臭氧可以将酚酞氧化,故C项正确;碘化银比氯化银更难溶,故D项错误。
本题难度:一般
2、实验题 某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是?。
第1组
| 第2组
| 第3组
|
S(单质)
| SO2、X、Na2SO3、NaHSO3
| SO3、H2SO4、Na2SO4、NaHSO4
|
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2?-76.1℃,SO3 ?16.8℃;沸点:SO2?-10℃,SO3?45℃)

①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是?。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是?;装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是?。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有40 mL 2.5mol/L NaOH溶液,反应后增重4.8 g,则装置Ⅳ中发生反应的化学方程式是?。
参考答案:(1)H2SO3 ?(2)①2SO2+O2 2SO3
2SO3
②使SO3凝结成固体与SO2分离?5SO2+2H2O+2MnO4—=5SO42—+2Mn2++4H+
③3SO2+4NaOH=Na2SO3+2NaHSO3+H2O
本题解析:(1)将相关的含硫物质依据硫元素化合价分组,依据低三族分类顺序,判断X为+4价的酸为H2SO3 ;
故答案为:H2SO3 ;
(2)①工业生产中SO2催化氧化的反应是二氧化硫的催化氧化反应;化学方程式为:2SO2+O2 2SO3;
2SO3;
故答案为;2SO2+O2 2SO3;
2SO3;
②装置II的作用是冷却装置,三氧化硫的沸点较低,通过冰水混合物,使SO3凝结成固体与SO2分离,装置III中高锰酸钾溶液会和二氧化硫反应逐渐褪色,生成Mn2+,二氧化硫被氧化为硫酸;
反应的离子方程式为:5SO2+2H2O+2MnO4=5SO42-+2Mn2++4H+;
故答案为:使SO3凝结成固体与SO2分离,5SO2+2H2O+2MnO4=5SO42-+2Mn2++4H+;
③若装置IV中有40mL 2.5mol?L-1NaOH溶液,反应后增重4.8g,吸收的为二氧化硫气体,依据二氧化硫物质的量和氢氧化钠物质的量进行分析判断生成产物,若n(SO2):n(NaOH)=1:2反应按照反应:SO2+2NaOH=Na2SO3+H2O;若n(SO2):n(NaOH)=1:1,反应按照反应SO2+NaOH=NaHSO3;装置IV中有40mL 2.5mol?L-1NaOH溶液中n(NaOH)=0.1mol,n(SO2)="4.8g÷64g/mol" =0.075mol;n(SO2):n(NaOH)=0.075:0.1=3:4,所以生成产物为亚硫酸钠和亚硫酸氢钠,反应的化学方程式依据直平法写出:3SO2+4NaOH═Na2SO3+2NaHSO3+H2O;
故答案为:3SO2+4NaOH═Na2SO3+2NaHSO3+H2O。
点评:本题考查了物质分类方法,规律总结,实验过程分析判断,化学方程式和离子方程式的书写,反应产物的分析判断,题目难度中等。
本题难度:简单
3、选择题 下列实验操作正确且能达到预期目的的是(?)
?
| 实验目的
| 操作
|
①
| 比较水和乙醇中羟基氢的活泼性强弱
| 用金属钠分别与水和乙醇反应
|
②
| 欲证明CH2=CHCHO中含有碳碳双键
| 滴入KMnO4酸性溶液,看紫红色是否褪去
|
③
| 欲除去苯中混有的苯酚
| 向混合液中加入浓溴水,充分反应后,过滤
|
④
| 证明SO2具有漂白性
| 将SO2通入酸性KMnO4溶液中
|
⑤
| 比较确定铜和镁的金属活动性强弱
| 用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液
|
⑥
| 确定碳和硅两元素非金属性强弱
| 测同温同浓度Na2CO3和Na2SiO3水溶液的pH
|
?
A.①④⑤?B.②③⑤? C.①⑤⑥?D.①②③④⑤⑥
参考答案:C
本题解析:②中—CHO干扰碳碳双键的检验,错误;③除去苯中的苯酚应用NaOH溶液,错误;④SO2能使酸性KMnO4溶液褪色,是因为其还原性,错误。
本题难度:一般
4、实验题 (5分)某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出):
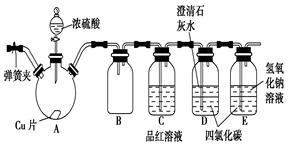
请回答下列问题:
(1)加热过程中,观察到A容器中出现大量白色烟雾,随着反应的进行,底部有白色沉淀生成,该沉淀物是________。
(2)对A容器中的浓H2SO4和铜片进行加热,很快发现C容器中品红溶液褪色,但始终未见D容器中澄清石灰水出现浑浊或沉淀。你的猜想是_______。设计实验验证你的猜想_____________。
参考答案:(共6分)(1)CuSO4 (1分)
(2)SO2溶解度较大,澄清石灰水中Ca(OH)2含量低,生成了Ca(HSO3)2溶液(2分。) 取样后,向其中加入氢氧化钠溶液,观察是否有沉淀生成(或者加盐酸检验SO2气体等方法)(2分。试剂或操作1分,现象描述1分)
本题解析:(1)铜和浓硫酸反应生成硫酸铜,加热的情况下,由于A容器中出现大量白色烟雾,导致溶剂减少,且浓硫酸具有吸水性,所以会析出白色固体硫酸铜。
(2)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,说明产生SO2气体的速率快,但始终未见D试管中澄清石灰水出现浑浊或沉淀,这是由于SO2溶解度较大,立即生成了Ca(HSO3)2溶液的缘故。因此验证猜想的方法是取样后,向其中加入氢氧化钠溶液,观察是否有沉淀生成(或者加热、加盐酸检验SO2气体等方法)。
点评:化学是一门以实验为基础的学科,所以有化学实验即科学探究之说法。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
本题难度:一般
5、实验题 用实验确定某酸HA是弱电解质。两同学的方案是:
甲:①称取一定质量的HA配制0.1mol/L的溶液100mL
②用pH试纸测出该溶液的pH值,即可证明HA是弱电解质
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察观象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是______________。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH________1(选填>、<、=) 乙方案中,说明HA是弱电解质的现象是________(多选扣分)
(a)装HCl溶液的试管中放出H2的速率快;
(b)装HA溶液的试管中放出H2的速率快;
(c)两个试管中产生气体速率一样快,
(3)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
________________________________
参考答案:(1)100mL容量瓶
(2)>;b
(3)配制NaA溶液,测其pH值>7即证明HA是弱电解质
本题解析:
本题难度:一般