|
高中化学知识点归纳《电解池原理》高频试题强化练习(2017年最新版)(八)
2017-03-02 23:09:44
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用铂电极电解100mL HNO3 与 AgNO3的混合液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合液中Ag+的物质的量浓度为
A.1mol·L-1
B.2 mol·L-1
C.2.5 mol·L-1
D.3 mol·L-1
|
参考答案:B
本题解析:铂电极为惰性电极,电解HNO3与AgNO3的混合溶液,通电一段时间后,两极均收集到2.24L气体(标准状况),n(气体)=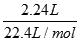 =0.1mol,由阳极发生4OH--4e-=2H2O+O2↑可知,生成0.1molO2转移0.4mol电子,根据电子守恒可知,阴极转移0.4mol电子,则阴极生成2.24L氢气转移2x0.1mol=0.2mol电子,故2Ag++2e-=2Ag转移电子数为0.4mol-0.2mol=0.2mol电子,即银离子的物质的量为0.2mol则原混合溶液中Ag+的物质的量浓度为 =0.1mol,由阳极发生4OH--4e-=2H2O+O2↑可知,生成0.1molO2转移0.4mol电子,根据电子守恒可知,阴极转移0.4mol电子,则阴极生成2.24L氢气转移2x0.1mol=0.2mol电子,故2Ag++2e-=2Ag转移电子数为0.4mol-0.2mol=0.2mol电子,即银离子的物质的量为0.2mol则原混合溶液中Ag+的物质的量浓度为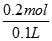 =2mol/L,答案为B. =2mol/L,答案为B.
考点:电解原理
本题难度:一般
2、选择题 用惰性电极电解+1价汞的硝酸盐溶液时,阴极上得到的产物是单质汞.当阴极消耗2mol该盐的阳离子时,阳极可得到1mol的气体产物,以下正确的是( )
A.阳极上产生氢气
B.电解时要消耗OH--,故溶液的PH值减小
C.阴极的电极反应式:O2+2H2O+4e-=4OH-
D.阳极的电极反应式:Hg++e-=Hg
参考答案:用惰性电极电解+1价汞的硝酸盐溶液时,阳极上发生的电极反应式为:4OH-=4e-+O2↑+2H2O,阴极上的电极反应为:Hg++e-=Hg.
A、阳极上发生的电极反应式为:4OH-=4e-+O2↑+2H2O,产生的是氧气,故A错误;
B、电解时,阳极上发生的电极反应式为:4OH-=4e-+O2↑+2H2O,阴极上的电极反应为:Hg++e-=Hg,要消耗OH--,故溶液的PH值减小,故B正确;
C、阴极上的电极反应为:Hg++e-=Hg,故C错误;
D、阳极上发生的电极反应式为:4OH-=4e-+O2↑+2H2O,故D错误.
故选B.
本题解析:
本题难度:一般
3、选择题 将0.2 mol AgNO3、0.4 mol Cu(NO3)2、0.6 mol KCl溶于水,配成100 mL溶液,用石墨电极电解一段时间后,若在一极析出0.3 mol Cu,试计算另一极上产生的气体体积(标准状况)。
参考答案:5.6 L
本题解析:三种物质溶于水时,AgNO3与KCl反应后溶液中含有0.2 mol KNO3、0.4 mol Cu(NO3)2和0.4 mol KCl。当有0.3 mol Cu生成时,先后发生反应:
Cu2++2Cl- Cu+Cl2↑① Cu+Cl2↑①
2Cu2++2H2O 2Cu+O2↑+4H+② 2Cu+O2↑+4H+②
在阳极上先后生成Cl2和O2。n(Cl2)=1/2n(KCl)=(1/2)×0.4 mol=0.2 mol,根据电子守恒有:0.3 mol×2=0.2 mol×2+4n(O2),解得n(O2)=0.05 mol,所以阳极共产生气体体积为:(0.2 mol+0.05 mol )×22.4 L·mol-1=5.6 L。
本题难度:一般
4、填空题 K2FeO4(高铁酸钾)在水处理、绿色高能电池制备、有机合成等方面都有广泛应用前景。K2FeO4本身的稳定性较差,在水溶液中发生反应:4K2FeO4+10H2O=4Fe(OH)3+8KOH+3O2↑ 研究人员在保持pH约
为9.40的水溶液中对K2FeO4的稳定性研究结果如下图所示。

图1:K2FeO4浓度为1×10-3 mol/L
图2:K2FeO4浓度为1×10-3 mol/L,加入的另一溶质浓度为0.02 mol/L,空白指未加其它试样(a-磷酸钠 b-草酸钠 c-空白 d-醋酸钠)
图3:K2FeO4浓度为1×10-3 mol/L,加入的另一溶质浓度为5×10-4 mol/L,空白指未加其它试样。
请据此回答下列问题:
(1)由图1可知,在保持pH约为9.40时,升高温度,K2FeO4的稳定性_________(填“增加”、“降低”或“不影响”)。
(2)由图2可知,在水溶液中分别加入磷酸钠、草酸钠、醋酸钠时,K2FeO4的稳定性顺序为__________________(用图中字母序号填空)。
(3)下图曲线e、f是加入NaCl的K2FeO4试样和空白对照实验所测结果。如果忽略Na+对K2FeO4稳定性的影响,其中加NaCl测得的曲线为_________。
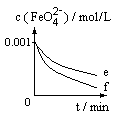
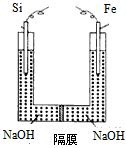
(4)我国学者提出在浓NaOH溶液(非饱和溶液)中用电化学方法来制备高铁酸盐,电解装置如下图。电解时,阳极的电极式反应为________________________。
(5)K2FeO4用于处理水时,不仅能消毒杀菌,还能吸附水中的悬浮杂质。请写出K2FeO4的还原产物在水中生成Fe(OH)3的离子方程式________________________。
(6)实验室保存K2FeO4的方法是__________________________。
参考答案:(1)降低
(2)d>b>a
(3)f
(4)Fe+8OH--6e-==FeO42-+4H2O
(5)Fe3++3H2O Fe(OH)3+3H+ Fe(OH)3+3H+
(6)低温下密封(保持干燥)保存
本题解析:
本题难度:一般
5、填空题 下图是两座工厂的主要生产流程以及它们之间的生产关系

回答下列问题:
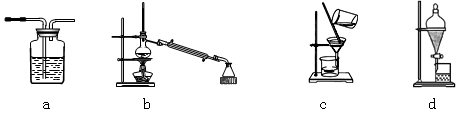
(1)与上图中“设备A”的作用相当的实验装置是 。
(2)“溶液B”也可以用下列物质中的什么物质代替? 。
a.KAl(SO4)2·12H2O b.ClO2 c.大量O3 d.K2Cr2O7 e.活性炭
(3)聚氯化铝在生产过程中作 剂,其作用是 ,可用离子方程式表示其化学原理如下(用Al3+代表聚氯化铝): 。
(4)上图中下方的工厂主要生产两种气体和一种常见强碱,通常称为 工业。
(5)加入“三种试剂”主要是为了除去粗食盐水中的Ca2+、Mg2+、SO42-等杂质,按加入的先后次序写出化学式 。
(6)制取“溶液B”的方法现在已作了改进,其原理图,用离子方程式表示该装置中发生的反应: 。

参考答案:(1)c
(2)b
(3)混凝剂(或化学沉降剂) 除去水中的悬浮物质 Al3++3H2O Al(OH)3(胶体) Al(OH)3(胶体)
(4)氯碱
(5)NaOH、BaCl2、Na2CO3
(6)Cl- + H2O ClO- + H2↑ ClO- + H2↑
本题解析:(1)湖水中含有不溶性杂质,因此通过设备A可以过滤除去得到溶液,所以与上图中“设备A”的作用相当的实验装置是c,其中a是洗气,b是蒸馏,d是分液,答案选c。
(2)根据流程图可知,设备C是净水的,因此设备B是消毒的,其中能由于消毒的是二氧化氯,其中a是明矾,作为净水剂,臭氧和重铬酸钾具有氧化性,一般不能用于水的消毒,活性炭具有吸附性,答案选b。
(3)聚氯化铝在生产过程中作混凝剂(或化学沉降剂),其作用是除去水中的悬浮物质,其化学原理如下(用Al3+代表聚氯化铝)Al3++3H2O Al(OH)3(胶体),生成的氢氧化铝胶体具有吸附性。 Al(OH)3(胶体),生成的氢氧化铝胶体具有吸附性。
(4)电解饱和食盐水生成氢气、氯气和氢氧化钠,属于氯碱工业。
(5)Ca2+用碳酸钠除去,Mg2+用氢氧化钠除去,SO42-用氯化钡除去,最后加入盐酸酸化。但由于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,而氢氧化钠可以随意调整,所以加入的先后次序的化学式可以是NaOH、BaCl2、Na2CO3;
(6)电解饱和食盐水生成氢气、氯气和氢氧化钠,生成的氯气溶解在氢氧化钠中生成次氯酸钠和水,所以反应的离子方程式可表示为Cl- + H2O ClO- + H2↑。 ClO- + H2↑。
考点:考查水的净化、氯碱工业、物质的分离与提纯等
本题难度:困难
|