微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 锂离子电池的广泛应用使回收利用锂资源成为重要课题。某研究性学习小组对废旧锂离子电池正极材料(LiMn2O4和碳粉涂覆在铝箔上)进行资源回收研究,设计实验流程如下
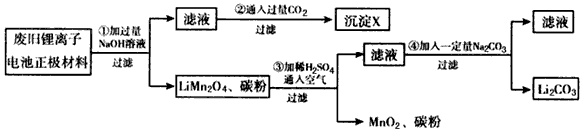
(1)第①步反应可能产生气体的化学式是________;第②步反应得到的沉淀X的化学式为_______。
(2)第③步反应有锂离子(Li+)生成,其反应的离子方程式是___________________。
(3)四步实验都包含过滤,实验室中过滤实验要使用的玻璃仪器包括_______。
(4)若废旧锂离子电池正极材料含LiMnO4的质量为18.1 g,第③步反应中加入 20.0 mL 3.0mol/L的H2SO4溶液,假定正极材料中的锂经反应③和④完全转化为Li2CO3,则至少有______g Na2CO3参加了反应。
参考答案:(1)H2;Al(OH)3
(2)4LiMn2O4+4H++O2=8MnO2+4Li++2H2O
(3)漏斗、烧杯、玻璃棒
(4)6.4或6.36
本题解析:
本题难度:一般
2、实验题 过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,请填写下列空白:
(1)移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250mL?(填仪器名称)中,加水衡释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。
??MnO4-+??H2O2+??H+=?Mn2++??H2O+□
(3)滴定时,将高锰酸钾标准溶液注入?(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是?。
(4)重 复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为?。
复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为?。
(5)下列操作能使测定结果偏高的是?
A.滴定前滴定管尖嘴中有气泡,滴定后气泡消失。
B.读取高锰酸钾标准溶液的刻度时,滴定前平视,滴定后俯视。
C.滴定前,在用蒸馏水洗涤滴定管后,未用高锰酸钾标准液润洗。
D.滴定过程中,锥形瓶中部分溶液溅出
参考答案:

本题解析:略
本题难度:一般
3、简答题 四氯化钛(TiCl4)是制取航天航空工业材料--钛合金的重要原料,由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:
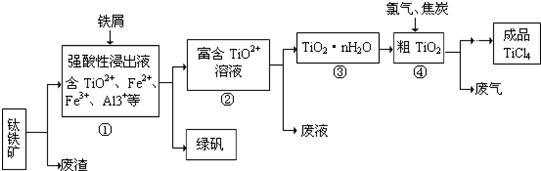
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性.该过程中有如下反应发生.
2Fe3++Fe═3Fe2+
2TiO2+(无色)+Fe+4H+═2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O═TiO2+(无色)+Fe2++2H+
加入铁屑的作用是______.
(2)在②→③工艺中需要控制条件以形成TiO2?n?H2O溶胶,该分散质颗粒直径大小在______范围.
(3)上述工艺具有成本低、可用低品位矿物为原料等优点.依据绿色化学理念,该工艺流程中存在的不足之处是______(只要求写出一项).
(4)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用______方法.
| TiCl4 | SiCl4
熔点/℃
-25.0
-68.8
沸点/℃
136.4
57.6
参考答案:(1)往①中加入铁屑至浸出液显紫色,说明浸出液中含有Ti3+,由方程式可知,Fe3+氧化为Ti3+,加入铁屑作还原剂,将Fe3+还原为Fe2+,防止Ti3+被Fe3+氧化成TiO2+,
故答案为:防止Ti3+被Fe3+氧化成TiO2+;
(2)控制条件以形成TiO2?n?H2O溶胶,说明得到胶体,其分散质颗粒直径大小为10-9~10-7m(或1nm-100nm),
故答案为:10-9~10-7m(或1nm-100nm);
(3)由工艺流程可知,生成中产生废气,废液,废渣等,不符合绿色化学理念,
故答案为:产生了废气,废液,废渣等;
(4)由表中数据可知,SiCl4、TiCl4为液体,二者沸点相差较大,要精制含少量SiCl4杂质的TiCl4,可采用蒸馏(或分馏)方法,
故答案为:蒸馏(或分馏).
本题解析:
本题难度:一般
4、实验题 (18分)工业生产的纯碱中常含有少量NaCl杂质。为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:
【方案一】取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量。
【方案二】用0.100 mol/L盐酸滴定。
【方案三】用稀酸将CO32-转化为CO2,测定CO2的质量。
解答1-4小题:
1.方案一的操作步骤有:①称量并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量并进行恒重操作。称量时所需定量实验仪器为____________________。判断是否达到恒重的标准是_____________________________________________________。
2.方案二的具体过程为:
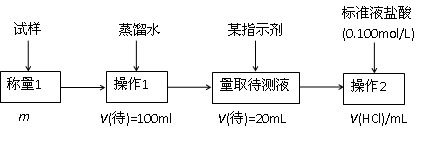
①操作1所需要的仪器有_____________________________________________。
②滴定时选择的指示剂为甲基橙。当溶液____________________________________时,说明达到了滴定终点。
③为减少偶然误差,通常的处理办法是_______________________________。
④滴定时若锥形瓶内有少量液体溅出,则测定结果_________。(选填“偏高”、“偏低”、“不影响”,下同),若盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗,测定结果_________。
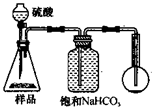
3.方案三的实验装置如下图:
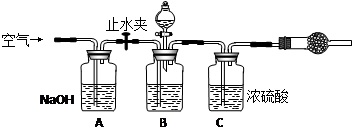
操作步骤有:①检查装置的气密性;②在干燥管内装满碱石灰,称量质量为W1 g;③称量W2 g样品装入广口瓶B中;④关闭止水夹;⑤缓慢加入稀H2SO4至不再产生气体为止;⑥ 打开止水夹;⑦缓缓鼓入空气数分钟,再称量干燥管,质量为W3 g。
该方案样品中纯碱的质量分数为__________________________(用代数式表示)。
上图中装置A的作用是_____________________。装置C的作用是_____________________。有同学认为空气中的水蒸气会进入干燥管导致测量结果_____________(填“偏大”、“偏小”或“无影响”)。改进措施可以是______________________________________________。
4.若用下图装置对样品进行分析,根据量瓶中收集到的液体的体积来计算样品中碳酸钠的含量。则下列装置中,最合理的是______。(选填序号)
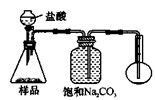 ? ?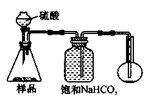 ? ?
A? B
 ? ? ? ?
C? D
参考答案:1.电子天平;前后两次称量的质量差不超过0.001g。
2. ①烧杯、玻璃棒、100mL容量瓶、胶头滴管
②溶液由黄色恰好变为橙色,且半分钟内不褪色
③做2~3次平行实验
④偏低,不影响
3.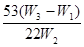 ;吸收空气中的CO2;吸收CO2中的水蒸气(干燥CO2气体);偏大;在干燥管右边再加一个装有碱石灰的干燥管 ;吸收空气中的CO2;吸收CO2中的水蒸气(干燥CO2气体);偏大;在干燥管右边再加一个装有碱石灰的干燥管
4.B
本题解析:略
本题难度:一般
5、选择题 关于物质的分离提纯,说法错误的是( )
A.蒸发操作可以从溶液中分离得到可溶性固体溶质
B.将待过滤的液体直接倒入漏斗中,且使液面低于滤纸边缘
C.蒸馏操作时,温度计的水银球不能伸入液面以下,只需靠近蒸馏烧瓶的支管口处
D.可以使用分液的方法分离植物油和水的混合物,植物油从分液漏斗上口倒出
参考答案:A.蒸发分离可溶性固体与液体,则蒸发操作可以从溶液中分离得到可溶性固体溶质,故A正确;
B.过滤的液体应利用玻璃棒引流,且使液面低于滤纸边缘,故B错误;
C.蒸馏时,测定馏分的温度,则蒸馏操作时,温度计的水银球不能伸入液面以下,只需靠近蒸馏烧瓶的支管口处,故C正确;
D.植物油和水混合后分层,水在下层,则可以使用分液的方法分离植物油和水的混合物,植物油从分液漏斗上口倒出,故D正确;
故选B.
本题解析:
本题难度:简单
|