|
高中化学必备知识点《电解池原理》试题特训(2017年最新版)(十)
2017-03-02 23:16:00
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3-的原理图所示。下列说法不正确的是:
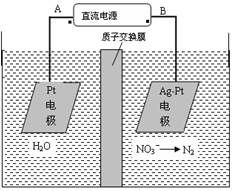
A.A为电源正极
B.阳极反应式为:2H2O-4e-=4H++O2↑
C.若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为10.4克
D.阴极反应式为:2NO3-+6H2O+10e-=N2↑+12OH-
参考答案:C
本题解析:本题考查电解原理的应用,利用反应类型定极,由题给原理图知,Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,电极反应式为:2NO3-+6H2O+10e-=N2↑+12OH-,则B为负极,A为电源正极,Pt电极为电解池的阳极,电极反应式为:2H2O-4e-=4H++O2↑;A、根据题给原理图知,在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极,正确;B、阳极为溶液中的氢氧根放电,氢氧根来自水的电离,电极反应式为:2H2O-4e-=4H++O2↑,正确;C、由阳极电极反应式知,转移2mol电子时,阳极区消耗1mol水,产生2molH+进入阴极室,阳极室质量减少18g;阴极室中放出0.2molN2(5.6g),同时有2molH+(2g)进入阴极室,因此阴极室质量减少3.6g,故膜两侧电解液的质量变化差(△m左-△m右)=14.4g,错误;D、阴极反应式为:2NO3-+6H2O+10e-=N2↑+12OH-,正确。
本题难度:一般
2、选择题 关于如图电解池工作时的相关叙述正确的是( )
A.Fe电极作阳极,发生氧化反应
B.C1-向石墨极作定向运动
C.石墨电极反应:Fe3++3e-═Fe
D.电解池发生总反应:2Cl-+2Fe3+ Cl2+2Fe2+
| 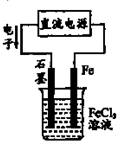
参考答案:A、电子流出的一极是电源的负极,故Fe连接电源的正极,为阳极,发生氧化反应,故A正确;
B、电解质溶液中,阴离子向阳极移动,Fe连接电源的正极,为阳极,故C1-向Fe极作定向运,故B错误
C、石墨是电解池的阴极,发生还原反应,电极反应为:Fe3++e-═Fe2+,故C错误;
D、Fe连接电源的正极,为阳极,是活性电极,Fe反应氧化反应生成Fe2+,石墨是电解池的阴极,发生还原反应,Fe3+放电生成Fe2+,故电解池发生总反应:Fe+2Fe3+?电解?.?3Fe2+,故D错误;
故选A.
本题解析:
本题难度:简单
3、选择题 用惰性电极电解下列各组物质的水溶液时,发生的电极反应完全相同的是( )
A.NaOH、H2SO4
B.CuCl2、Cu(NO3)2
C.Na2SO4、NaCl
D.KNO3、AgNO3
参考答案:A、惰性电极电解氢氧化钠溶液、硫酸溶液,依据离子放电顺序分析实质是电解水,阳极电极反应为4OH--4e-=2H2O+O2↑,阴极电极反应为2H++2e-=H2↑,故A正确;
B、依据溶液中阴阳离子放电顺序分析,惰性电极电解氯化铜溶液实质电解氯化铜,电极反应为阳极为:2Cl--2e-=Cl2↑,阴极为Cu2++2e-=Cu,电解Cu(NO3)2是电解硝酸铜和水,阳极电极反应为4OH--4e-=2H2O+O2↑,阴极电极反应为Cu2++2e-=Cu,电极反应不同,故B错误;
C、依据溶液中阴阳离子放电顺序分析,惰性电极电解Na2SO4实质是电解水,阳极电极反应为4OH--4e-=2H2O+O2↑,阴极电极反应为2H++2e-=H2↑,惰性电极电解NaCl溶液是电解氯化钠和水,阳极电极反应2Cl--2e-=Cl2↑,阴极电极反应为2H++2e-=H2↑,电极反应不同,故C错误;
D、依据溶液中阴阳离子放电顺序分析,惰性电极电解KNO3实质是电解水,阳极电极反应为4OH--4e-=2H2O+O2↑,阴极电极反应为2H++2e-=H2↑,惰性电极电解AgNO3 溶液是电解AgNO3和水,阳极电极反应为4OH--4e-=2H2O+O2↑,阴极电极反应为Cu2++2e-=Cu,电极反应不同,故D错误;
故选A.
本题解析:
本题难度:简单
4、简答题 铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸.某化学研究小组在实验室中按下列步骤模拟该生产过程.填写下列空白:
(1)配制实验用的溶液.要配制200mL密度为1.2g?cm-3的溶质质量分数为16%的NaOH溶液,需要称取______g NaOH固体.
(2)把铝片浸入热的16%NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗.写出除去氧化膜的离子方程式______.
(3)如图,组装好仪器,接通开关K,通电约25min.在阳极生成氧化铝,阴极产生气体.写出该过程中的电极反应式:
阳极______
阴极______
(4)断开电路,取出铝片,用1%稀氨水中和表面的酸液,再用水冲洗干净.写出该过程发生反应的离子方程式______.
参考答案:(1)200mL密度为1.2g?cm-3的溶质质量分数为16%的NaOH溶液,溶液中氢氧化钠质量=200ml×1.2g?cm-3×16%=38.4g;
故答案为:38.4;
(2)铝表面有氧化铝,氧化铝是两性氧化物溶于氢氧化钠溶液中反应生成四羟基合铝酸钠或偏铝酸钠,反应的离子方程式为:Al2O3+2OH-+3H2O=2[A1(OH)4]-或Al2O3+2OH-=2AlO2-+H2O;
故答案为:Al2O3+2OH-+3H2O=2[A1(OH)4]-或Al2O3+2OH-=2AlO2-+H2O
(3)装置图分析铝接电源正极在电解池中 做阳极失电子生成氧化铝,电极反应为:2Al+3H2O→Al2O3+6H++6e-;溶液中氢离子在阴极得到电子生成氢气,电极反应为:6H++6e-→3H2↑;
故答案为:2Al+3H2O→Al2O3+6H++6e-?6H++6e-→3H2↑;
(4)用1%稀氨水中和表面的酸液,是和稀硫酸发生的反应,反应离子方程式为:NH3?H2O+H+=NH4++H2O;
故答案为:NH3?H2O+H+=NH4++H2O;
本题解析:
本题难度:一般
5、填空题 (15分)(1)从NaCl、CuSO4两种电解质中选取适当的物质,按电解要求填写(填化学式):
①以铜为电极,进行电解时电解质浓度不变,则采用的电解质是__________。
②以碳棒为电极,进行电解时使电解质和水的质量均变小,则采用的电解质是________。
此电解反应的阳极反应式: ,电解池的总反应化学方程式: 。
(2)①甲同学用直流电源、碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)===CuSO4+H2↑,则该同学选用的阳极材料是_______。
②乙同学在做铜与稀硫酸的上述反应实验时,看到碳棒和铜棒上都有气泡产生,但铜棒却没有被腐蚀。请你选出最可能的原因 (填字母代号)
A.铜被稀硫酸钝化 B.碳棒和铜棒与电源正负极接反
此时的电解池的总反应为____________ ____________
参考答案:(15分)(1)①CuSO4 (2分)
②NaCl (2分) 2Cl--2e-=Cl2↑(2分)
2NaCl+2H2O 2NaOH+H2↑+Cl2↑(3分) 2NaOH+H2↑+Cl2↑(3分)
(2)①铜棒 (2分)
②B(2分) 2H2O 2H2↑+O2↑ 2H2↑+O2↑
本题解析:(1)①以铜为电极,进行电解时,电极氯化钠溶液,阳极是Cu失去电子生成铜离子进入溶液,阴极是氢离子放电生成氢气,氯化钠的浓度增大;而电解硫酸铜溶液,阳极是Cu失去电子进入溶液,阴极是铜离子得到电子生成单质铜析出,所以硫酸铜的浓度基本不变,所以选择CuSO4;
②以碳棒为电极,进行电解时,电解氯化钠溶液,阴极是水电离产生的氢离子放电生成氢气,阳极是氯离子放电生成氯气,则溶液中的水和氯化钠的质量都减小;电解硫酸铜溶液,阴极是铜离子放电生成单质铜,阳极是氢氧根离子放电,产生氧气,所以溶液中的硫酸铜与水的质量都减少,二者均符合题意,答案是NaCl、CuSO4;阳极的反应式为2Cl--2e-=Cl2↑或2H2O-4e-= O2↑+4H+;总反应方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑或2 CuSO4+2H2O 2NaOH+H2↑+Cl2↑或2 CuSO4+2H2O 2 H2SO4+O2↑+2Cu; 2 H2SO4+O2↑+2Cu;
(2)①Cu+H2SO4(稀)===CuSO4+H2↑该反应一般不会实现,但在电解时用Cu作阳极,稀硫酸作电解质溶液,则该反应会发生;
②首先Cu与稀硫酸不会发生钝化,当电源的正负极接反时,Cu作阴极,则Cu不会参加反应,该反应实质是电解水,答案选B;电解水的化学方程式为2H2O 2H2↑+O2↑ 。 2H2↑+O2↑ 。
考点:考查电化学原理的应用,实验现象的分析与判断
本题难度:困难
| 