微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 ⅠA、B、C、D四种元素在周期表中分别处于元素X的四周(如图),已知X元素最高价氧化物的化学式为X2O5,且五种元素中有一种元素的原子半径是它们所处的同族中最小的.试确定:
(1)各元素的符号:
A:______,B:______,C:______,D:______,X:______.
(2)写出C、D、X最高价氧化物对应水化物的化学式,并排列酸性由强到弱的顺序:______.
(3)写出A、B、X气态氢化物的化学式,并排列稳定性由强到弱的顺序:______.
ⅡFe3+和I-在水溶液中的反应如下:2I-+2Fe3+?2Fe2++I2(水溶液),
(1)该反应的平衡常数K的表达式为:K=______.
[物质的浓度用“c(物质)”表示].当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,上述平衡______移动(填“向右”、“向左”、“不”).
(2)上述反应的正向反应速率和I-、Fe3+的浓度关系为:v=K[c(I-)]m[c(Fe3+)]n(其中K为常数)
| c(I-)(mol/L) | c(Fe3+)(mol/L) | v[mol/(L?s)]
(1)
0.20
0.80
0.032K
(2)
0.60
0.40
0.144K
(3)
0.80
0.20
0.128K
|
通过所给的数据计算得知:
①在v=K[c(I-)]m[c(Fe3+)]n中,m、n的值为______.
A.m=1、n=1?B.m=1、n=2?C.m=2、n=1?D.m=2、n=2
②I-浓度对反应速率的影响______Fe3+浓度对反应速率的影响(填“>”、“<”或“=”).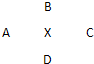
参考答案:Ⅰ.(1)X2O5中X的化合价为+5,则X是VA族元素.由于五种元素中有一种元素的原子半径是它们所处的同族中最小的,这种元素只能是B.B为VA族的第一种元素N,则X为P,D为As,A为Si,C为S,故答案为:Si;N;S;As;P;?
(2)由于非金属性:S>P>As,元素的非金属性越强,对应的最高价氧化物对应水化物的酸性强越强,则有酸性:H2SO4>H3PO4>H3AsO4,
故答案为:H2SO4>H3PO4>H3AsO4;?
(3)元素的非金属性越强,对应的氢化物越稳定,非金属性:N>P>Si,则有稳定性:NH3>PH3>SiH4,
故答案为:NH3>PH3>SiH4;
Ⅱ.(1)该反应的平衡常数K的表达式为k=c2(Fe2+)×c(I2)c2(I-)×c2(Fe3+),加入CCl4萃取了I2,减小了生成物浓度,反应速率降低,从而使得v(正)>v(逆),导致平衡向右移动,
故答案为:c2(Fe2+)×c(I2)c2(I-)×c2(Fe3+);向右;
(2)将表中的三组数据代入公式v=k[c(I-)]m?[c(Fe3+)]n
得0.20m×0.80n=0.032K,
0.60m×0.40n=0.144K,
0.80m×0.20n=0.128K,
解之得:m=2,n=1,
所以I-浓度对反应速率的影响大,故答案为:C;>.
本题解析:
本题难度:一般
2、填空题 “物质结构与性质”模块(10分)
请回答下列问题:
(1)N、AI、Si、Zn四种元素中,有一种元素的电离能数据如下:

(2)则该元素是__①___(填写元素符号)。Zn原子的电子排布式是__②__。Ce的最高价氯化物分子式是_ __③___。该元素可能的性质或应用有__④___。
A.是一种活泼的金属元素
B.其电负性大于硫
C.其单质可作为半导体材料
D.其最高价氯化物的沸点低于其溴化物的沸点
关于化合物?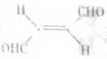 ?,下列叙述正确的有 ?⑤??。
?,下列叙述正确的有 ?⑤??。
A.分子间可形成氢键
B.分子中既有极性键又有非极性键
C.分子中有7个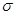 键和1个
键和1个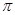 键
键
D.该分子在水中的溶解度大于2-丁烯
(4)NaF的熔点?⑥?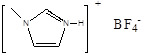 的熔点(填>、<或=),其原因是?⑦
的熔点(填>、<或=),其原因是?⑦
参考答案:
①AI
②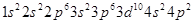
③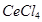
④C、D
⑤B、D
⑥>
⑦两者均为离子化合物,且阴阳离子电荷数均为1,但后者的离子半径较大,离子键较弱,因此其熔点较低
本题解析:
(1)该元素在第四电离能发生突变,该元素为正三价,为铝元素;根据能量最低原理和核外电子排布规律不难写出电子排布式;Ge和C为同族元素,Ge最高价为+4价,氯化物分子式为GeCl4。Ge位于金属和非金属分界线附近,既具有金属性,也具有一定的非金属性,可作为半导体材料;Ge不是一种活泼的金属;Ge为金属,电负性要小于硫;Ge的氯化物和溴化物均为分子晶体,相对分子质量越大,分子间作用力越大,Ge的溴化物沸点更高。
分子中含有碳碳非极性共价键,也含有碳氢极性共价键,B项正确;分子中含有4个 C-H和3个
C-H和3个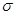 C-C?和2个
C-C?和2个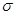 C-O,3个π键,1个πC=C和2个πC=O?;该分子中含有两个醛基,溶解度要大于2-丁烯。
C-O,3个π键,1个πC=C和2个πC=O?;该分子中含有两个醛基,溶解度要大于2-丁烯。
(4)两者均为离子化合物,晶格能越大,熔点越高;两者阴阳离子电荷数均为1,但后者的离子半径较大,晶格能小,因此其熔点较低。
【考点定位】本题考查较为综合,涉及电子排布式、分子的立体构型、杂化轨道类型、化学键类型等知识,具有一定的难度。
本题难度:困难
3、填空题 二氯化硫(S2Cl2)是一种琥珀色液体,是合成硫化染料的重要原料。它的熔点-80℃,沸点138℃。常温下,它遇水易反应,产生使品红褪色的气体,且溶液出现浑浊。
(1)写出S2Cl2的电子式_____________________,该分子中Cl—S的键长_______S—S的键长(填“>”,“<”或“=”)。
(2)S2Cl2遇水反应产生气体,该气体分子的空间构型为?,中心原子的杂化轨道类型为____ 。
(3)HF、H2S、HCl的稳定性由大到小的顺序为?,沸点由高到低的顺序
为??。
(4)写出二氯化硫与水反应的化学方程式?。
参考答案:(1)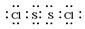 ?; < ;(2)V形;sp2;
?; < ;(2)V形;sp2;
(3)HF>HCl>H2S ; HF>HCl>H2S ;?(4)2S2Cl2+2H2O=SO2 ↑+3S↓+4HCl
本题解析:(1)S2Cl2分子中S原子之间形成1对共用电子对,Cl原子与S原子之间形成1对共用电子对,电子式为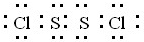 ;同周期自左向右原子半径逐渐减小,所以S原子半径大于氯原子半径,故Cl-S的键长<S-S的键长。
;同周期自左向右原子半径逐渐减小,所以S原子半径大于氯原子半径,故Cl-S的键长<S-S的键长。
(2)S2Cl2遇水易水解,并产生能使品红溶液褪色的气体,该气体为二氧化硫,。根据价层电子对互斥理论可知,S原子的孤对电子对数=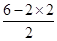 =1,价层电子对数=2+1=3,故二氧化硫为V形,S原子形成sp2杂化。
=1,价层电子对数=2+1=3,故二氧化硫为V形,S原子形成sp2杂化。
(3)非金属性越强,氢化物的稳定性越强。非金属性F>Cl>S,因此氢化物稳定性是HF>HCl>H2S;氟化氢分子之间存在氢键,沸点最高,氯化氢与硫化氢都形成分子晶体,HCl的相对分子质量大,沸点比硫化氢高,故沸点由高到低的顺序为HF>HCl>H2S。
(4)S2Cl2遇水易水解,并产生能使品红溶液褪色的气体,该气体为二氧化硫,在反应过程中硫元素一部分升高到+4价(生成SO2),一部分降低到0价(生成S),由原子守恒可知还生成水,所以根据电子得失守恒可知反应方程式为2S2Cl2+2H2O=SO2↑+3S↓+4HCl。
本题难度:一般
4、选择题 下列分子中,具有极性键的非极性分子的组合是
[? ]
A.H2、NH3、H2S
B.CS2、BF3、CO2
C.CH3Cl、CH2Cl2、CH4
D.SO2、NO2、C2H2
参考答案:B
本题解析:
本题难度:简单
5、填空题 无机反应大多反应速率较快,而有机反应大多反应速率较慢且副反应多,其原因是________________。
参考答案:无机反应大多是离子之间的直接反应,只需破坏离子键而无需破坏离子内的化学键,故反应速率较快。而有机反应多为非电解质(是共价化合物)之间的反应,反应时需破坏原有的共价键并形成新的共价键需要很高的能量,且旧键的断裂和新键的形成方式可能有多种,因而反应速率慢,且副反应多。
本题解析:
本题难度:一般