微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
?
| 
| ?
|
?
| ?
| ?
| ?
| A
| B
| C
| ?
| ?
|
?
| ?
| ?
| D
| E
| ?
| ?
| ?
|
?
| N
| ?
| M
| ?
| Q
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
| | | | | | | | | | | | | | | | |
|
?
⑴A、B、C原子的第一电离能由小到大的顺序是__________(用元素符号表示);
Q元素基态原子电子排布式为?。
⑵写出BC2+的电子式?,1mol BC2+中含有的π键数目为?。
⑶化合物甲由B、D两元素组成,已知甲是一种重要的结构材料,硬度大,耐磨损,晶胞如图1所示甲的晶体中B、D两种元素原子的杂化方式均为?。

⑷法国科学家阿尔贝·费尔和德国科学家彼得·格林贝格尔因在巨磁电阻效应(CMR效应)研究方面的成就而获得诺贝尔物理学奖。如图2的化合物具有CMR效应,则该化合物的化学式为?。
参考答案:(12分)⑴C<O<N? 1s22s22p63s23p63d54s1
⑵  ?2NA
?2NA
⑶sp3
⑷CaTiO3
本题解析:略
本题难度:一般
2、选择题 下列含有同一元素的含氧酸中酸性强弱比较正确的是( )?
A.H2SO3>H2SO4?
B.HNO3>HNO2?
C.H3PO3>HPO3?
D.HClO>HClO4
参考答案:BC?
本题解析:同种元素的不同价态的无机含氧酸,价态越高,酸性越强。?
本题难度:简单
3、填空题 自然界中往往存在许多有趣也十分有意义的现象,下表列出了若干化合物的结构式、分子式、相对分子质量和沸点。
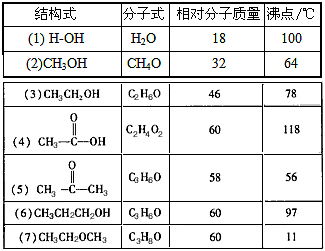
由表中物质的沸点可以得出什么结论?
_________________________________________
参考答案:(1)组成和结构相似的化合物,相对分子质量越大,沸点越高;
(2)分子间存在氢键,会使沸点升高,氢键越强,沸点越高。
本题解析:
本题难度:一般
4、填空题 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素原子的价层电子总数是内层电子总数的2倍;D元素原子的L电子层中只有两对成对电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1) E元素基态原子的核外价层电子排布式为_________。
(2)用元素符号表示B、C、D三种元素的第一电离能由低到高的排序_________。
(3) A元素与B、C元素可形成化合物B2A4、C2A4。
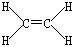
①B2A4的结构式为_________。
②下列有关C2A4的说法正确的是_________。
a.一个该分子中含有4个σ键
b.该分子可作为配位体形成配位键
c.该分子是非极性分子? d.1mol该分子最多可形成4mol氢键
e.该分子的稳定性与氢键无关
f.该分子中C的原子轨道是sp3杂化
(4)B单质的一种的晶体结构如图甲所示,E单质的一种的晶体结构如图乙所示。
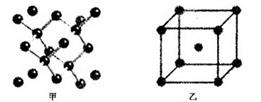
则图中的单质B的名称_________,图甲中B原子的配位数与图乙中E原子的配位数之_________。
E元素与D元素形成的ED晶体与NaCl晶体一样,欲比较ED与NaCl的晶格能大小,需考虑的数据是_______________________________________________________________________________。
(5)据最新资料显示,F单质的晶胞可能有多种,若其晶胞分别以六方紧密堆积和面心立方堆积存在时,其单质的密度之比为_________。
参考答案:(每空2分,第(4)第1空1分,共计15分)(1)3d64s2(2)B<D<C
(3) ?② b、e、f(全对2分,选对1~2个得1分,选错一个均不得分)
?② b、e、f(全对2分,选对1~2个得1分,选错一个均不得分)
(4)金刚石;1:2 ;离子的半径与离子所带的电荷
(5)3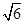 :8
:8
本题解析:B元素原子的价层电子总数是内层电子总数的2倍,所以B是碳元素。D元素原子的L电子层中只有两对成对电子,因此D是氧元素。C的原子序数介于B和D中间,则C是氮元素。E元素的基态原子有4个未成对电子,这说明E应该是第四周期元素,可能是Cr或Fe。E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,所以E只能是Fe,F是Cu。
(1)铁的原子序数是26,根据构造原理可知,其价电子排布式为3d64s2。
(2)B为碳元素,C为氮元素,D为氧元素,同周期第一电离能自左而右具有增大趋势,所以第一电离能O>C。由于氮元素原子2p能级有3个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素,所以B、C、D三种元素的第一电离能数值由小到大的顺序为C<O<N。
(3)A元素与B、C元素可形成化合物B2A4、C2A4,这说明A应该是氢元素。
①B2A4是乙烯,其的结构式为 。
。
②C2A4的结构式是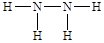 ,所以a. 一个该分子中含有5个σ键,a不正确;b.该分子中氮元素含有孤对电子,所以可作为配位体形成配位键,b周期;c.该分子不对称,是极性分子,c不正确;d.由于氮元素可以形成氢键,所以平均1个N2H4分子可以形成6÷2=3个氢键,因此1mol该分子最多可形成3mol氢键,d不正确;e.氢键不是化学键,不影响物质的稳定性,即该分子的稳定性与氢键无关,e正确;f.该分子中N原子的原子轨道是sp3杂化,f正确,答案选bef。
,所以a. 一个该分子中含有5个σ键,a不正确;b.该分子中氮元素含有孤对电子,所以可作为配位体形成配位键,b周期;c.该分子不对称,是极性分子,c不正确;d.由于氮元素可以形成氢键,所以平均1个N2H4分子可以形成6÷2=3个氢键,因此1mol该分子最多可形成3mol氢键,d不正确;e.氢键不是化学键,不影响物质的稳定性,即该分子的稳定性与氢键无关,e正确;f.该分子中N原子的原子轨道是sp3杂化,f正确,答案选bef。
(4)根据晶胞的几个可知,甲是金刚石。根据晶胞结构可知,金刚石中配位数是4,而铁是体心立方堆积,配位数是8,所以甲中B原子的配位数与图乙中E原子的配位数之1:2;E元素与D元素形成的ED晶体与NaCl晶体一样,都是离子晶体,所以欲比较ED与NaCl的晶格能大小,应该比较晶格能大小,即需要考虑的数据是离子的半径与离子所带的电荷。
(5)体心立方晶胞中铜原子个数=1+8×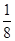 =2;面心立方晶胞中实际含有的铜原子个数=6×
=2;面心立方晶胞中实际含有的铜原子个数=6×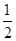 +8×
+8×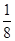 =4。设铜原子半径是a,六方紧密堆积和面心立方堆积的边长分别为x和y,则x2+2x2=(4a)2、y2+y2=(4a)2,解得x=
=4。设铜原子半径是a,六方紧密堆积和面心立方堆积的边长分别为x和y,则x2+2x2=(4a)2、y2+y2=(4a)2,解得x=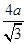 、y=
、y=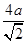 ,所以根据
,所以根据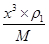 ×NA=2、
×NA=2、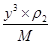 ×NA=4可知,二者的密度之比ρ1:ρ2=3
×NA=4可知,二者的密度之比ρ1:ρ2=3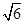 :8。
:8。
本题难度:一般
5、选择题 CCTV-1《焦点访谈》栏目中曾报道“铊中毒事件”,铊再次成为公众关注的焦点.铊的相关信息如图所示,其中“6s26p1”表示铊原子有6个电子层,最外层有3个电子.下列有关卡片信息解读不正确的是( )
A.铊的元素符号为Tl
B.铊原子的质子数为81
C.铊位于第六周期ⅢA族
D.铊的金属性比铝的金属性弱
