分液
参考答案:D
本题解析:A、除去乙酸乙酯中的乙酸应加入饱和碳酸钠溶液,然后分液,错误;B、除去二氧化碳中的二氧化硫应将混合气体通入盛有饱和碳酸氢钠溶液的洗气瓶,错误;C、除去乙烷中的乙烯用酸性高锰酸钾溶液会引入新的杂质二氧化碳,错误;D、除去溴苯中的溴可向其中加入氢氧化钠溶液,然后分液,错误。
本题难度:一般
2、简答题 (1)请指出下列做法中分别应用了哪些分离方法?(过滤、蒸发、蒸馏、萃取、结晶)
a、熬煮中药______?b、分离豆浆和豆渣______c、用海水晒盐______?d、海水淡化___ ___
(2?)今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、H+、Mg2+、Ba2+、CO32-、SO42-,现取两份100mL溶液进行如下实验:
①第一份加入足量NaHCO3溶液后,收集到气体0.03mol.
②第二份加足量Ba(NO3)2溶液充分反应后过滤干燥,得干燥沉淀4.66g.
根据上述实验回答:
(a)原溶液中一定不存在的离子是______.
(b)原溶液中可能存在的离子是______.
(c)请计算出原溶液中一定存在的阴离子的物质的量浓度______.
参考答案:(?1?)熬煮中药用的是萃取的方法进行分离;豆渣不能透过滤纸,可用过滤的方法分离;用海水晒盐用的是蒸发的方法分离;可通过蒸馏的方法进行海水淡化,
故答案为:萃取;过滤;蒸发;?蒸馏;
(?2?)(?a?)?第一份加入足量NaHCO3溶液后,收集到气体0.03mol,说明溶液呈酸性,则存在H+离子,不存在CO32-离子,根据溶液的电中性原则,则一定含有SO42-,
那么,就不可能存在Ba2+,故答案为:Ba2+、CO32-;
(?b?)根据H++HCO3-=H2O+CO2↑,则有n(H+)=n(CO2)=0.03mol,第二份加足量Ba(NO3)2溶液充分反应后过滤干燥,得干燥沉淀4.66g,该沉淀为BaSO4,则有
n(SO42-)=n(BaSO4)=4.66g233g/mol=0.02mol,根据溶液电中性原则可知溶液中还应有?K+、Mg2+离子中的至少一种,
故答案为:K+、Mg2+;
(c?)n(SO42-)=n(BaSO4)=4.66g233g/mol=0.02mol,则c(SO42-)=0.02mol0.1L=0.2mol/L,故答案为:0.2?mol/L.
本题解析:
本题难度:一般
3、选择题 只用一种试剂就能鉴别己烯、甲苯、乙醇、四氯化碳4种无色液体,这种试剂是( ?)
A.溴水
B.盐酸
C.酸性高锰酸钾溶液
D.紫色石蕊试液
参考答案:A
本题解析:与溴水的反应现象分别为褪色、有色层在上层、互溶、有色层在下层。
点评:此题通过选择试剂来区分无色液体,考核了对常见有机物与相关物质反应的现象,平时在记忆物质的性质时,要注意对其现象的记忆。
本题难度:一般
4、选择题 现有一瓶乙二醇和丙三醇的混合物,已知它们的性质如下表。据此,将乙二醇和丙三醇相互分离的最佳方法是

[? ]
A.萃取法
B.结晶法
C.分液法
D.分馏法
参考答案:D
本题解析:
本题难度:简单
5、实验题 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂。制备硝基苯的过程如下:①配制混酸:组装如下图反应装置。
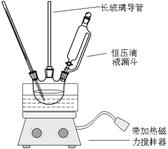
取100 mL烧杯,用20 mL浓硫酸与浓硝酸18 mL配制混和酸,加入漏斗中。把18 mL苯加入三颈烧瓶中。
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀。
③在50-60℃下发生反应,直至反应结束。
④除去混和酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品。
已知(1)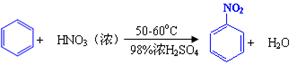
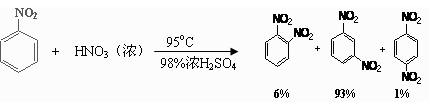
(2)可能用到的有关数据列表如下
物质
| 熔点/℃
| 沸点/℃
| 密度(20 ℃) / g·cm-3
| 溶解性
| 苯
| 5.5
| 80
| 0.88
| 微溶于水
| 硝基苯
| 5.7
| 210.9
| 1.205
| 难溶于水
| 1,3-二硝基苯
| 89
| 301
| 1.57
| 微溶于水
| 浓硝酸
| 
| 83
| 1.4
| 易溶于水
| 浓硫酸
| 
| 338
| 1.84
| 易溶于水
|
?
请回答下列问题:
(1)配置混酸应先在烧杯中先加入?。
(2)恒压滴液漏斗的优点是?。
(3)实验装置中长玻璃管可用?代替(填仪器名称)。
(4)反应结束后产品在液体的?层(填“上”或者“下”),分离混酸和产品的操作方法为?。
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净??。
(6)为了得到更纯净的硝基苯,还须先向液体中加入?除去水,然后蒸馏,
参考答案:(1)浓硝酸
(2)可以保持漏斗内压强与发生器内压强相等,使漏斗内液体能顺利流下
(3)冷凝管(球形冷凝管或直行冷凝管均可)
(4)上?分液
(5)取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净。
(6) 氯化钙
本题解析:(1)由于浓硫酸的密度比浓硝酸的大,当浓硫酸遇水时放出大量的热,所以配置混酸应将浓硫酸加入到浓硝酸中,也就是先在烧杯中先加入浓硝酸。(2)由于在反应的过程中不断加热,会产生大量的气体,这对于液体的加入很不利。若采用恒压滴液漏斗滴加,可以保持漏斗内压强与发生器内压强相等,使漏斗内液体能顺利流下。(3)在实验的过程中苯、硝酸会因为加热而气化,导致物质的浪费与环境污染,所以在装置中长玻璃管可以起到冷凝、降温使物质回流的作用。因此可用冷凝管等冷凝装置代替。(4)反应结束后产生的硝基苯、1,3-二硝基苯都不溶解于水的液体,密度比酸的混合溶液小。所以反应结束后产品在液体的上层,分离互不相溶的两层液体的方法是分液。(5)对于得到的粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤。如果洗涤干净,则洗涤液中不含有CO32-。所以检验液体已洗净的方法是取最后一次洗涤液,向溶液中加入氯化钙,若无沉淀生成,说明已洗净。(6)为了得到更纯净的硝基苯,使之不含有水,可以先向液体中加入有吸水干燥作用的无水CaCl2,除去水,然后蒸馏。就得到了产品。
本题难度:困难
|