微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组离子中,能在同一溶液中大量共存、溶液无色,加入一小块钠粒后仍能大量共存的是(?)
A.K+、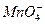 、
、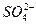 、H+
、H+
B.Ba2+、Na+、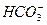 、
、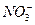
C.Na+、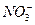 、K+、Cl-
、K+、Cl-
D.Ca2+、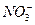 、Cl-、
、Cl-、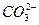
参考答案:C
本题解析:A中MnO-4使溶液显紫色。D中Ca2+与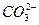 不能大量共存。B中加入Na后,Na与水反应生成NaOH,
不能大量共存。B中加入Na后,Na与水反应生成NaOH,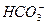 与OH-反应生成
与OH-反应生成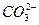 ,
,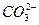 与Ba2+结合成BaCO3沉淀,所以B不合题意。
与Ba2+结合成BaCO3沉淀,所以B不合题意。
2Na+2H2O====2Na++2OH-+H2↑
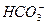 +OH-====
+OH-====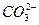 +H2O
+H2O
Ba2++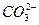 ====BaCO3↓
====BaCO3↓
本题难度:简单
2、填空题 碱金属能形成离子型氢化物。如氢化钠的化学式为NaH,其中H-具有较强的还原性。
(1)常用NaH在高温下将TiCl4还原成Ti,反应的化学方程式为_________________________。
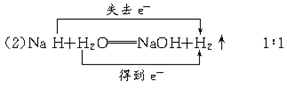
(2)NaH能与水剧烈反应生成对应的碱和氢气,反应的化学方程式为_________________ ,并在化学方程式中标明电子转移的方向和数目。该反应中氧化产物和还原产物的质量比为_____________________。
参考答案:(1)2NaH+TiCl4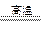 Ti+2NaCl+2HCl↑
Ti+2NaCl+2HCl↑
本题解析:(1)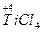

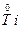 ,Ti元素价态降低,得电子,是氧化剂,NaH和TiCl4反应,谁的价态升高?显然是还原性的H-,Ti已变为单质,Na、H、Cl三元素如何结合?生成NaCl、HCl是必然结果:
,Ti元素价态降低,得电子,是氧化剂,NaH和TiCl4反应,谁的价态升高?显然是还原性的H-,Ti已变为单质,Na、H、Cl三元素如何结合?生成NaCl、HCl是必然结果:
2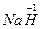 +
+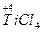 (原子的重新组合)
(原子的重新组合)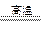 2NaCl+2
2NaCl+2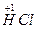 ↑+
↑+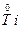 ,用化合价升降总值相等进行验证,十分合理。
,用化合价升降总值相等进行验证,十分合理。
(2)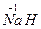 与
与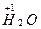 反应生成
反应生成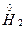 ,发生了氧化还原反应,从价态变化看,应该是+1价H原子得到了-1价H原子的电子。又由于H2O可以发生微弱的电离——水是极弱电解质,所以生成的碱应为NaOH:
,发生了氧化还原反应,从价态变化看,应该是+1价H原子得到了-1价H原子的电子。又由于H2O可以发生微弱的电离——水是极弱电解质,所以生成的碱应为NaOH:
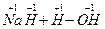 ====NaOH+H2↑
====NaOH+H2↑
(正、负相互吸引,一种化合价的正价原子或原子团跟另一种化合物中的负价原子或原子团重新结合)用化合价升降总值相等验证,也是合理的。
H2既是氧化产物,又是还原产物。
本题难度:简单
3、选择题 下列各组中的两种物质作用时,反应条件或反应物的用量改变时,对生成物没有影响的是
[? ]
A、Na2O2 与CO2
B、NaOH与CO2
C、Ca(OH)2与NaHCO3
D、Na与O2
参考答案:A
本题解析:
本题难度:简单
4、选择题 欲观察H2燃烧的颜色,燃气导管的材料最好是(?)
A.钠玻璃
B.钾玻璃
C.石英玻璃
D.铜管
参考答案:C
本题解析:Na、K、Cu元素的焰色:黄、紫、绿,产生干扰,不利于观察H2燃烧时的颜色。在石英玻璃(主要成分是SiO2)管口燃烧,无干扰。
本题难度:简单
5、选择题 碳酸氢钠受热容易分解为碳酸钠。现加热5.00 g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了0.31g,则原混合物中碳酸钠的质量为( )
A.3.38 g
B.4.58 g
C.4.16 g
D.4.41 g
参考答案:C
本题解析:根据反应的化学方程式可知
2NaHCO3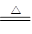 Na2CO3+H2O+CO2↑?△m↑
Na2CO3+H2O+CO2↑?△m↑
168g? 62g
m? 0.31g
解得m=0.84g
所以碳酸钠的质量是5.00g-0.84g=4.16g答案选C
点评:该题是高考中的常见题型,属于中等难度的试题,试题注重基础和能力的双向考查。该题主要是要掌握差量法在化学计算中的重要应用,有利于培养学生分析问题、解决问题的能力。
本题难度:一般