微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 工业上以碳酸锰矿为主要原料生产MnO2的工艺流程如下:
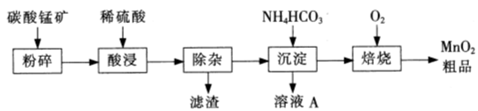
有关氢氧化物开始沉淀和沉淀完全的pH如下表:

请问答下列问题:?
(1)酸浸前将碳酸锰矿粉碎的作用是??。
(2)酸浸后的溶液中含有Mn2+、 SO42-,另含有少量Fe2+、Fe3+.A13+、Cu2+、Pb2+等,其除杂过程如下:
①加入MnO2将Fe2+氧化,其离子反应方程式为 ?。?
②加入CaO将溶液的pH调到5.2~6.0,其主要目的是 ??。
③加入BaS,除去Cu2~、Pb2+后,再加入NaF溶液,除去 ?。
(3)从溶液A中回收的主要物质是?,该物质常用作化肥。?
(4)MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,然后再用氧化剂将Mn2+转化为MnO2,制得优质MnO2。写出Mn3O4与稀硫酸反应韵化学方程式:
??。
参考答案:
(1)增大接触面积,加快反应速率(使反应更充分)
(2)@2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O?②除去Fe3~,A13+?③Ca2+
(3)(NH4)2SO4 ?
(4)Mn3O4+2H2SO4=2MnSO4+MnO2+2H2O? (每空2分,本题共12分)
本题解析:化工流程题,(1)将反应物粉碎的作用是增大接触面积,加快反应速率,使反应更充分;(2)pH调到5.2~6.0,其主要目的是除去Fe3~A13+和部分Cu2+;③溶液中除去Fe2+、Fe3+、A13+、Cu2+、Pb2+,但第②加入了Ca2+,再加入NaF溶液,显然是除去Ca2+;(3)流程得到的是碳酸锰沉淀,溶液中主要剩余NH4+和SO42-,故回收的物质是(NH4)2SO4 。
本题难度:困难
2、选择题 下列实验方案设计正确的是? ( )
A.分解高锰酸钾制取氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤
B.失去标签的AgNO3溶液、稀盐酸、NaOH溶液、AlCl3溶液可选用(NH4)2CO3溶液作鉴别试剂
C.用铜丝代替铂丝做焰色反应
D.在裂化汽油中加入酸性高锰酸钾,振荡后若紫色褪去即可证明其中含甲苯等苯的同系物
参考答案:B
本题解析:加入(NH4)2CO3溶液时,AgNO3溶液中产生白色沉淀,稀盐酸中产生无色无味气体,NaOH溶液中产生无色有刺激性气味的气体,AlCl3溶液中既有白色沉淀又有无色无味气体产生。高锰酸钾分解后残留的二氧化锰可以用热的浓盐酸洗涤,不能用稀盐酸来清洗。做焰色反应实验应选用铂丝或铁丝,不能选用铜丝,因为铜丝灼烧时会产生明显的绿色火焰。裂化汽油中含有较多的烯、炔等不饱和烃,能使酸性高锰酸钾溶液褪色。
本题难度:一般
3、选择题 重结晶过程中如果所选溶剂对杂质的溶解度很小,而对被提纯有机物的溶解度比较大,那么热过滤后
A.被提纯有机物在滤液中
B.杂质在滤液中
C.杂质留在滤纸上
D.被提纯有机物留在滤纸上
参考答案:AC
本题解析:如果所选溶剂对杂质的溶解度很小即杂质难溶,被提纯有机物易溶液,所以热过滤后被提纯有机物在滤液中、杂质留在滤纸上;
本题难度:一般
4、选择题 下列物质除杂(括号内物质为杂质)所用试剂正确的是( )
| 物质 | 试剂]
A
Na2SO4溶液(NaBr)
Cl2
B
FeCl2溶液(FeCl3)
Cu
C
Cl2(HCl)
饱和食盐水
D
CO2(HCl)
饱和Na2CO3溶液
|
A.A
B.B
C.C
D.D
参考答案:A.发生2NaBr+Cl2=2NaCl+Br2,生成NaCl,引入新杂质,故A错误;
B.生成CuCl2,引入新杂质,应用Fe除杂,故B错误;
C.Cl2不溶于饱和食盐水,可用饱和食盐水除杂,故C正确;
D.CO2和HCl都可与饱和Na2CO3溶液反应,应用饱和碳酸氢钠溶液除杂,故D错误.
故选C.
本题解析:
本题难度:一般
5、填空题 研究小组欲进行从海水中获取淡水、食盐并提取镁和溴等物质的实验探究。
(1)无需经过化学变化就能从海水中获得的一组物质是?(填序号)。
① Cl2、Br2、I2?② Na、Mg、Al?③烧碱、氢气?④食盐、淡水
(2)在生产过程中,从海水中提取镁的流程如下图所示:

贝壳中的主要成分是:___________(填化学式);反应①属于________反应(填“吸热”或“放热”)。
反应②的化学方程式为??。
(3)实验室从海水样品中提取溴的主要步骤是:向海水样品中通入适量氯气将溴离子氧化,该反应的离子方程式为?;从反应后的溶液中提取溴单质的实验操作是____________(填实验操作名称)。
参考答案:(1)④(1分);
(2)CaCO3(1分);?放热(1分);? MgCl2(熔融态) Mg+Cl2↑ (2分);
Mg+Cl2↑ (2分);
(3)Cl2+2Br-=2Cl-+Br2(2分);萃取(1分)
本题解析:(1)①从海水中提炼溴和碘,是用氯气把其中的碘离子和溴离子氧化为碘单质和溴单质,是化学变化,同样要得到氯气,需要电解熔融的氯化钠,也是化学变化,①不正确;②要从海水中得到钠、镁,需要首先从海水中获得氯化钠和氯化镁,然后再去电解熔融状态的氯化钠和氯化镁,得钠和镁,是化学变化,故②错误;③电解饱和食盐水,得到烧碱、氢气和氯气,是化学变化,故③错误;④氯化钠在海水中的浓度很大,用蒸馏等方法可以从海水中得到淡水,海水经太阳暴晒,蒸发水分后即得食盐,不需要化学变化就能够从海水中获得。同样经过蒸馏也可以得到淡水,属于物理变化,故④正确,答案选④。
(2)贝壳中的主要成分是碳酸钙,碳酸钙高温分解生成氧化钙和CO2。氧化钙溶于水得到氢氧化钙,该反应是放热反应;氢氧化钙与海水混合生成氢氧化镁白色沉淀,氢氧化镁内盐酸溶解生成氯化镁。镁是活泼的金属,要冶炼金属镁,需要电解熔融的氯化镁即得到镁和氯气,反应的化学方程式为MgCl2(熔融态) Mg+Cl2↑。
Mg+Cl2↑。
(3)氯气的氧化性强于单质溴的,因此氯气能氧化溴离子生成单质溴,反应的离子方程式为Cl2+2Br-=2Cl-+Br2;由于单质溴易溶在有机溶剂中,因此从反应后的溶液中提取溴单质的实验操作是萃取。
本题难度:一般