微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知氢化钠(NaH)属于离子化合物,NaH和水反应放出H2.下列叙述正确的是
A.NaH和水反应后溶液呈酸性
B.NaH是一种强氧化剂
C.NaH中的氢离子可以被还原成氢气
D.NaH的氢离子与锂离子的电子层结构相同
参考答案:D
本题解析:
本题难度:简单
2、选择题 下列离子方程式书写错误的是
A.将过量NaOH溶液滴入同浓度的少量Ca(HCO3)2溶液中:
B.向Ba(OH)2溶液中逐滴加入NaHSO4溶液至刚好沉淀完全:
C.向Ca(ClO)2溶液中通入适量SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO
D.向FeBr2溶液中加入过量氯水:
参考答案:CD
本题解析:分析:A、氢氧化钠过量,溶液中碳酸根离子大于钙离子的物质的量;
B、刚好沉淀完全,溶液中氢氧根离子剩余,氢离子不足;
C、次氯酸具有强氧化性,不会生成亚硫酸钙;
D、氯水过量,溶液中的溴离子被氧化成溴单质.
解答:A、由于氢氧化钠过量,溶液中碳酸根离子大于钙离子的物质的量,碳酸根离子有剩余,离子方程式是:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O,故A正确;
B、由于刚好沉淀完全,溶液中氢氧根离子剩余,氢离子不足,反应的离子方程式是:Ba2++OH-+H++SO42-=BaSO4↓+H2O,故B正确;
C、生成的次氯酸具有强氧化性,不会生成亚硫酸钙,正确离子方程式是:2SO2+2H2O+Ca2++2ClO-→CaSO4↓+4H++2Cl-+SO42-,故C错误;
D、向FeBr2溶液中加入过量氯水,正确的离子方程式是2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故D错误;
故选CD.
点评:本题考查了离子方程式的书写,注意反应中过量、不足量的处理,本题难度不大.
本题难度:困难
3、选择题 物质之间相互反应 时,加入的量不同往往反应不尽相同,在给定条件下反应,下列叙述?正确的是(? )
A.NaHCO3与石灰水反应,当n(NaHCO3):n[Ca(OH)2]=1︰1时,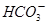 完全转化为CaCO3
完全转化为CaCO3
B.CO2通入石灰水中,当n(CO2)︰n[Ca(OH)2]=1︰1时,能得到澄清溶液
C.AlCl3溶液与烧碱溶液反应,当n(OH-)︰n(Al3+)=1︰1时,铝元素以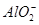 形式存在
形式存在
D.Fe与稀硝酸反应,当n(Fe)︰n(HNO3)=1︰1时,溶液中铁元素只以Fe3+形式存在
参考答案:A
本题解析:A选项n(NaHCO3):n[Ca(OH)2]=1︰1时,CO32-个数与Ca2+个数正好1︰1,应完全生成CaCO3,正确。B选项n(CO2)︰n[Ca(OH)2]=1︰1时,应完全生成白色沉淀,错误。C选项Al3+生成Al(OH)3白色沉淀,错误。D选项n(Fe)︰n(HNO3)=1︰1时,溶液中既有Fe3+又有Fe2+,错误。
本题难度:一般
4、选择题 已知某溶液中存在较多的H+和SO42-,则该溶液中还可以大量共存的离子组是
A.Al3+、CO32-、Cl-
B.Mg2+、Ba2+、Cl-
C.Mg2+、Fe2+、NO3-
D.Na+、NH4+、Cl-
参考答案:D
本题解析:分析:溶液中存在较多的H+和SO42-,再利用离子之间不能结合生成沉淀、水、气体,不能发生氧化还原反应,不能发生相互促进水解的反应来分析.
解答:A、因H+和CO32-结合生成水和气体,且Al3+、CO32-相互促进水解,则该组离子不能大量共存,故A错误;
B、因Ba2+、SO42-,能结合生成硫酸钡沉淀,则该组离子不能大量共存,故B错误;
C、因H+和Fe2+、NO3-能发生氧化还原反应,则该组离子不能大量共存,故C错误;
D、因该组离子之间不反应,则能够大量共存,故D正确;
故选D.
点评:本题考查离子的共存问题,熟悉复分解反应发生的条件、氧化还原反应、水解等知识可解答,难度不大.
本题难度:一般
5、选择题 把①蔗糖、②淀粉、③纤维素、④蛋白质? 在稀硫酸存在下分别进行水解,最后产物只有一种物质的是
A.②③
B.③④
C.④
D.①②③④
参考答案:A
本题解析:蔗糖水解的最终产物是葡萄糖和果糖;淀粉、纤维素水解的最终产物是葡萄糖;蛋白质水解的最终产物是多种氨基酸.
本题难度:困难