微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 A、B、C、D、E五种短周期元素,原子序数依次增大,有关信息如下。
元素
| 有关信息
|
A
| 最高价氧化物对应的水化物与其氢化物反应生成离子化合物
|
B
| 地壳中含量最多的元素
|
C
| 单质须保存在煤油中
|
D
| 单质既可与盐酸反应,又可与NaOH溶液反应
|
E
| 原子最外层电子数比次外层电子数少1个
|
?
请回答下列问题:
(1)A的氢化物的水溶液能使酚酞试液变红,原因是(用电离方程式表示),实验室制取该氢化物的化学方程式是?。
(2)A与B可组成质量比为7∶16的三原子分子,下列环境问题与该物质的排放有关的是(填序号)。
①酸雨?②温室效应?③臭氧层破坏?④光化学污染
(3)C的最高价氧化物的水化物与E单质反应可用于生产消毒液,其离子方程式是?。
(4)D在元素周期表中的位置是。由元素A、D组成某化合物,具有良好电绝缘性,该物质与水缓慢反应的化学方程式是?。
参考答案:(1)NH3·H2O NH4++OH-(1分)
NH4++OH-(1分)
2NH4Cl+Ca(OH)2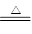 CaCl2+2NH3↑+2H2O(1分)
CaCl2+2NH3↑+2H2O(1分)
(2)①④(2分,选对1个得1分,有错不得分)
(3)Cl2+2OH-=Cl-+ClO-+H2O(1分)
(4)第3周期ⅢA族(1分)
AlN+3H2O=Al(OH)3↓+NH3↑(2分)
本题解析:最高价氧化物对应的水化物与其氢化物反应生成离子化合物说明是硝酸铵,A为氮元素;地壳中含量最多的元素是氧,则B为氧元素。C单质须保存在煤油中可知是钠元素。D单质既可与盐酸反应,又可与NaOH溶液反应可知是铝元素。E原子最外层电子数比次外层电子数少1个,是氯元素。(1)A的氢化物的水溶液能使酚酞试液变红,原因是NH3·H2O NH4++OH-;实验室制取该氢化物的化学方程式是2NH4Cl+Ca(OH)2
NH4++OH-;实验室制取该氢化物的化学方程式是2NH4Cl+Ca(OH)2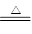 CaCl2+2NH3↑+2H2O。(2)A与B可组成质量比为7∶16的三原子分子是二氧化氮,可以产生①酸雨;④光化学污染。(3)生产消毒液,其离子方程式是Cl2+2OH-=Cl-+ClO-+H2O。(4)D在元素周期表中的位置是第3周期ⅢA族;由元素A、D组成某化合物AlN,与水缓慢反应的化学方程式是AlN+3H2O=Al(OH)3↓+NH3↑。
CaCl2+2NH3↑+2H2O。(2)A与B可组成质量比为7∶16的三原子分子是二氧化氮,可以产生①酸雨;④光化学污染。(3)生产消毒液,其离子方程式是Cl2+2OH-=Cl-+ClO-+H2O。(4)D在元素周期表中的位置是第3周期ⅢA族;由元素A、D组成某化合物AlN,与水缓慢反应的化学方程式是AlN+3H2O=Al(OH)3↓+NH3↑。
本题难度:一般
2、选择题 下列关于胶体和溶液的说法中,正确的是
A.向煮沸的1 mol/L NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体
B.布朗运动是胶体粒子特有的运动方式,可以据此把胶体与溶液、悬浊液区分
C.胶粒带有电荷,但是整个分散系仍是电中性的
D.胶体粒子很小,可以透过半透膜
参考答案:C
本题解析:A:按题意只能制得Fe(OH)3沉淀,而制得氢氧化铁胶体的过程为:向沸水中逐滴加入5~6滴饱和氯化铁溶液,继续煮沸至溶液呈红褐色,停止加热,即可;B:布郎运动的产生,与粒子所处体系中的分散剂分子对粒子无休止的随机撞击有关,并不是粒子本身固有的性质;C:所述正确;D:胶粒不能透过半透膜。
本题难度:一般
3、选择题 下表为元素周期表短周期的一部分。下列有 关A、B、C、D、E五种元素的叙述中,不正确的是(?)
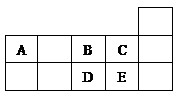
A.A与B形成的阴离子可能有:AB32- 、A2B42-
B.E的氢化物的沸点比C的氢化物的沸点高
C.D在过量的B中燃烧的主要产物为DB2
D.A与E形成的化合物是非极性分子
参考答案:B
本题解析:根据元素在周期表中的位置可知,A、B、C、D、E五种元素分别是C、O、F、S、Cl。A正确,B不正确,由于氟化氢分子间存在氢键,其沸点高于氯化氢的,CD是正确的,答案选B。
本题难度:简单
4、选择题 38Sr(锶)与37Rb(铷)是同周期的相邻元素,下列有关锶的说法错误的是
A.38Sr是第3周期ⅡA族元素
B.Sr的离子半径比Kr(氪)的原子半径大
C.Sr的碳酸盐受热会分解
D.Sr的氧化物对应水化物碱性比Rb的氧化物对应水化物碱性弱
参考答案:AB
本题解析:38Sr是第5周期元素,A不正确。Sr离子和Kr的核外电子排布相同,原子序数越大,微粒半径越小,锶的原子序数大于氪的,B不正确。同主族元素,性质相似,且自上而下金属性逐渐增强,所以C、D均正确。答案选AB。
本题难度:一般
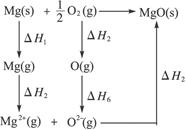
5、计算题 (9分)用下列数据求氧原子的电子亲和能
Mg(s) Mg(g)?ΔH1="141" kJ·mol-1
Mg(g)?ΔH1="141" kJ·mol-1
Mg(g) Mg2+(g)?ΔH2="2" 201 kJ·mol-1
Mg2+(g)?ΔH2="2" 201 kJ·mol-1
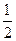 O2
O2 O(g)?ΔH3="247" kJ·mol-1
O(g)?ΔH3="247" kJ·mol-1
Mg2+(g)+O2-(g) MgO(s)?ΔH4="-3" 916 kJ·mol-1
MgO(s)?ΔH4="-3" 916 kJ·mol-1
Mg(s)+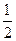 O2(g)
O2(g) MgO(s)?ΔH5="-602" kJ·mol-1
MgO(s)?ΔH5="-602" kJ·mol-1
参考答案:氧的电子亲和能为:E=-ΔH6="-725?" kJ·mol-1
本题解析:根据题给数据设计玻恩—哈伯循环
有盖斯定律得
ΔH5=ΔH1+ΔH2+ΔH3+ΔH4+ΔH6
ΔH6=ΔH5-ΔH1-ΔH2-ΔH3-ΔH4
="-602" kJ·mol-1-141 kJ·mol-1-2 201 kJ·mol-1-247 kJ·mol-1-3 916 kJ·mol-1="725" kJ·mol-1
本题难度:简单