微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对于3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),反应的化学平衡常数的表达式为( )
Fe3O4(s)+4H2(g),反应的化学平衡常数的表达式为( )
A.K=
B.K=
C.K=
D.K=
参考答案:D
本题解析:略
本题难度:简单
2、选择题 工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)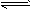 Si(s)+4HCl(g);△H=+QkJ·mol-1 (Q>0)。某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是
Si(s)+4HCl(g);△H=+QkJ·mol-1 (Q>0)。某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是
[? ]
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH恰好反应
参考答案:D
本题解析:
本题难度:一般
3、选择题 对于平衡体系,mA(气)+ nB(气)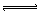 pC(气)+qD(气)+ Q有下列判断,其中正确的是?
pC(气)+qD(气)+ Q有下列判断,其中正确的是?
A.若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.48倍,则m+ n> p+ q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C.若平衡体系共有气体a mol,再向其中加入b mol B,当重新达到平衡时,气体的总物质的量等于(a+b),则m+n=p+q
D.温度不变时,若压强增大至原来的2倍,达到新平衡时,
参考答案:B、C
本题解析:A中体积增大1倍,则压强变为原来的1/2,A的浓度变为原来的0.48倍,A的浓度减小了,故平衡向正反应方向移动了,证明正反应是一个气体体积增大的反应,即m+n<p+q。
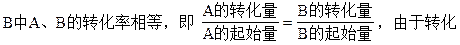
量之比等于方程式中系数比,故起始反应物的物质的量之比也应等于系数比。
C中向平衡体系中加入b mol B,重新达平衡时,气体物质的量没变仍为(a+b)mol,证明该反应是一个等体积的反应,即(m+n)=p+q。
D中若m+n= p+q,则当压强增大到原来的2倍时,达平衡时的总体积刚好为原体积的 1/2。故 A、D的说法是错误的,B、C是正确的。
本题难度:一般
4、选择题 下列有关反应限度的说法错误的是
A.某条件下可逆反应达到限度之前,逆反应速率逐渐增大可能与生成物浓度逐渐增大有关
B.炼铁高炉尾气中CO含量不随高炉高度改变而改变,是因为有关反应达到了限度
C.化学反应的限度决定了反应物在该条件下的最大转化率
D.可逆反应的限度不随反应条件的改变而改变
参考答案:D
本题解析:A.某条件下可逆反应达到限度之前,反应从正反应方向开始,逆反应速率逐渐增大,就是由于反应物不断反应变为生成物,使生成物浓度逐渐增大。物质的浓度越大,反应速率也就越快。正确。B.在炼铁高炉中发生的CO还原氧化铁的反应是可逆反应。当反应达到该条件下的反应限度时,无论高炉高度改变与否,尾气中CO含量不随而改变。正确。C.当化学反应达到该条件下的化学反应的限度时,各种反应物也就得到了在该条件下的最大转化率,因此化学反应的限度决定了反应物在该条件下的最大转化率。正确。D.可逆反应的限度是在一定条件下的限度。若外界条件发生改变,则平衡被破坏,就会达到新的条件下的新的限度,因此会随反应条件的改变而改变。错误。
本题难度:一般
5、选择题 一定条件下,在2SO2+O2  2SO3的化学平衡体系中,各物质的浓度分别是:SO2:2mol/L,O2 : 0.8mol/L,SO3 : 2.4mol/L,则氧气在起始时的浓度可能是?(?)
2SO3的化学平衡体系中,各物质的浓度分别是:SO2:2mol/L,O2 : 0.8mol/L,SO3 : 2.4mol/L,则氧气在起始时的浓度可能是?(?)
A.0.8—2mol/L
B.0—2mol/L
C.0—0.8mol/L
D.无法确定
参考答案:B
本题解析:根据可逆反应的最大特点是不完全进行,所以最低不能为0 mol/L,2.4mol/L SO3最多可生成1.2mol/L,但是不能生成1.2mol/L,所以最大值是2mol/L。
本题难度:简单