微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下述根据下列操作和现象,所得结论正确的是
| 实验操作及现象
| 实验结论
|
A
| 分别向2 mL 0.1 mol·L-1 CH3COOH溶液和2 mL 0.1 mol·L-1 H3BO3溶液中滴加等浓度的NaHCO3溶液,前者有气泡产生,后者无明显现象
| 酸性:
CH3COOH > H2CO3> H3BO3
|
B
| 向浓度均为0.1 mol·L-1 NaCl 和NaI 混合溶液中滴加少量AgNO3溶液,产生黄色沉淀
| 溶度积:
Ksp(AgCl)<Ksp(AgI)
|
C
| 向无水乙醇中加入浓H2SO4,加热,产生的气体通入酸性KMnO4溶液,紫色褪去
| 证明生成了乙烯
|
D
| 将少量的溴水滴入NaI溶液中,再滴加CCl4,振荡、静置,溶液分为两层:上层溶液无色,下层溶液紫红色
| 氧化性:Br2>I2
|
参考答案:AD
本题解析:A、根据强酸制弱酸的原理,醋酸与碳酸氢钠溶液反应生成二氧化碳,说明醋酸酸性大于碳酸,而H3BO3与碳酸氢钠溶液混合,无气体产生,说明酸性H2CO3> H3BO3,正确;B、向浓度均为0.1 mol·L-1 NaCl 和NaI 混合溶液中滴加少量AgNO3溶液,产生黄色沉淀,说明AgI比AgCl更难溶,则Ksp(AgCl)>Ksp(AgI),错误;C、向无水乙醇中加入浓H2SO4,加热,产生的气体通入酸性KMnO4溶液,紫色褪去,不能说明生成了乙烯,因为乙醇易挥发,且乙醇也能使酸性高锰酸钾溶液褪色,错误;D、将少量的溴水滴入NaI溶液中,则生成碘和NaBr,再滴加CCl4,碘在四氯化碳中的溶解度大于在水中的溶解度,且四氯化碳的密度大于水与水不互溶,在下层,所以振荡、静置,溶液分为两层:上层溶液无色,下层溶液紫红色,正确,答案选AD。
考点:考查反应的原理判断,现象与结论的分析判断
本题难度:一般
2、填空题 小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”.
(1)实验前小明预测说:Fe2+肯定既有还原性又有氧化性.你认为他预测的依据是:______.
(2)小明欲用实验证明他的预测.实验室提供了下列试剂:3%的H2O2溶液、锌粒、铜片、0.1mol?L-1FeCl2溶液、KSCN溶液、新制氯水.
①若小明计划在0.1mol?L-1FeCl2溶液滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应是:______写离子方程式),可能观察到的现象是:溶液由浅绿色变为______?色.
②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据.你认为可选______(填名称)滴入小明所得的混合液中,并通过溶液出现______色的现象,证明小明的观点和实验方案都是正确的.
③对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入FeCl2溶液中,结果铜片没变化,锌粒逐渐变小.由此说明三种金属的还原性由强至弱的顺序为:______.
(3)小明分析H2O2中氧元素显-1价(中间价),并提出疑问:H2O2与FeCl2的反应时,Fe2+还作氧化剂吗?
①请你为小明梳理相关问题:若Fe2+在反应中表现出氧化性应转化成______(填微粒符号,下同),若Fe2+在反应中表现出还原性应转化成______.
②实际上Fe2+的还原性较强,实验室的FeCl2溶液常因氧化而变质.除杂的方法是:______,相关反应的离子方程式:______.
参考答案:(1)元素化合价处于最高价只具有氧化性,处于最低价只具有还原性,处于中间价态既可以升高也可以降低,既具有氧化性又具有还原性;故答案为:因为Fe2+中铁元素化合价处于中间价态,可以升高也可以降低;
(2)①在0.1mol?L-1FeCl2溶液滴入新制氯水,氯气具有强氧化性能源和亚铁离子为铁离子,反应的离子方程式为:Cl2+2Fe2+=2Cl-+2Fe3+;溶液颜色从浅绿色变为黄色;
故答案为:Cl2+2Fe2+=2Cl-+2Fe3+;黄;
②通过检验Fe2+被氧化的产物Fe3+的存在以获取证据.需要的试剂为硫氰酸钾溶液,发生反应,Fe3++3SCN-=Fe(SCN)3,溶液变血红色,故答案为:硫氰酸钾溶液;红色;
③金属单质都具有还原性,分别将铜片、锌粒投入FeCl2溶液中,结果铜片没变化,锌粒逐渐变小,发生反应Zn+Fe2+=Fe+Zn2+;氧化还原反应中还原剂的还原性大于还原产物,锌的还原性大于铁,铁大于铜,故答案为:Zn?Fe?Cu;
(3)①若Fe2+在反应中表现出氧化性,化合价降低做氧化剂,只能降到0价为金属铁,若Fe2+在反应中表现出还原性,铁元素化合价升高为三价,应转化成三价铁离子;
故答案为:Fe,Fe3+;
②实验室的FeCl2溶液常因氧化而变质,为反之亚铁离子的氧化,需要加入还原铁粉,发生反应2Fe3++Fe=3Fe2+;避免亚铁离子的氧化,故答案为:加入适量铁粉,2Fe3++Fe=3Fe2+;
本题解析:
本题难度:一般
3、实验题 (15分)为了探究H2O2、H2SO3和Br2氧化性的相对强弱,设计如下实验(夹持仪器已略去)。请回答下列问题:
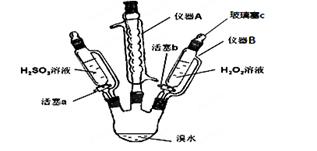
(1)仪器A的名称_________,其作用是___________。
(2)用仪器B滴加液体并不需要打开玻璃塞c,原因是____________________________。
(3)实验记录如下(请补全空白):
步骤
| 实验操作
| 实验现象
| 实验结论
|
Ⅰ
| 打开活塞a,逐滴加入H2SO3溶液至过量
| ________________
| __________________________
|
Ⅱ
| 向步骤Ⅰ所得溶液中逐滴加入H2O2溶液
| 刚开始溶液颜色无明显变化,继续滴加,溶液变为橙黄色
| __________________________
|
(4)步骤Ⅱ中,开始时颜色无明显变化的原因是(写出一条)_______________________,
步骤Ⅰ中反应的离子方程式_________________________________________________,
步骤Ⅱ中主要反应的离子方程式_____________________________________________。
参考答案:(1)球形冷凝管(或冷凝管) 回流溴(或以免溴挥发等) (2)滴液漏斗和三颈瓶气压相通
(3)Ⅰ:橙黄色褪去 Br2的氧化性大于H2SO3 Ⅱ:H2O2的氧化性大于Br2
(4)步骤1的H2SO3有过量,H2O2先和H2SO3反应(H2O2浓度小或Br-与H2O2反应慢等都可)
H2SO3+Br2+H2O=4H++SO42-+2Br- H2O2+2Br-+2H+=Br2+2H2O
本题解析:
试题解析:(1)仪器A的名称是球形冷你管,其作用是使溴蒸汽冷凝回流。(2)用仪器B滴加液体并不需要打开玻璃塞c,原因是该仪器与三颈瓶相同,气压相等,液体能顺利流出。(3)Ⅰ:打开活塞a,逐滴加入H2SO3溶液至过量,H2SO3被溴水氧化,溶液的橙黄色褪去,说明溴单质的氧化性强于亚硫酸;Ⅱ:向步骤Ⅰ所得溶液中逐滴加入H2O2溶液,溶液又变为橙黄色,说明过氧化氢将溴离子氧化为溴单质,则H2O2的氧化性大于Br2;(4)步骤Ⅱ中,开始时颜色无明显变化可能是因为步骤1的H2SO3有过量,H2O2先和H2SO3反应,或H2O2浓度小或Br-与H2O2反应慢等;步骤Ⅰ中,亚硫酸与溴单质反应,离子方程式为:H2SO3+Br2+H2O=4H++SO42-+2Br-;步骤Ⅱ中主要发生过氧化氢和溴离子的反应,离子方程式为: H2O2+2Br-+2H+=Br2+2H2O。
考点:实验方案的设计
本题难度:困难
4、选择题 向酸化过的MnSO4溶液中滴加(NH4)2S2O8(过二硫酸铵)溶液会发生反应:Mn2++S2O82-+H2O
参考答案:
本题解析:
本题难度:一般
5、选择题 X、Z、Y、W 均为四种金属, 根据下列事实:①X+Y2+=X2++Y;②Z+2H2O(冷水)=Z(OH)2+H2↑;③Z2+的氧化性比X2+弱;④由Y、W电极组成的原电池,电极反应为W2++2e-=W、Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序为? (? )
A.X﹥Z﹥Y﹥W
B.Z﹥W﹥X﹥Y
C.Z﹥Y﹥X﹥W
D.Z﹥X﹥Y﹥W
参考答案:D
本题解析:根据同一化学反应中,还原剂的还原性大于还原产物的还原性,据此分析X、Y、Z、W的还原性强弱。
①X+Y2+=X2++Y,X作还原剂,Y是还原产物,所以X的还原性大于Y的还原性;
②Z+H2O(冷)=Z(OH)2+H2↑,Z能与冷水反应作还原剂,所以Z的还原性最强;z作还原剂,氢气是还原产物,所以Z的还原性大于氢气的还原性;
③Z2+氧化性比X2+弱,所以Z的还原性大于X的还原性;
④由Y、W电极组成的电池,电极反应为W2++2e-=W、Y-2e-=Y2+,Y是还原剂,W是还原产物,所以Y的还原性大于W的还原性;
所以X、Y、Z、W的还原性由强到弱的顺序为Z>X>Y>W。
故选D。
点评:本题考查了还原性强弱的比较,难度不大,明确同一化学反应中,还原剂的还原性大于还原产物的还原性,氧化剂的氧化性大于氧化产物的氧化性。
本题难度:简单