微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 减少SO2的排放、回收利用SO2成为世界性的研究课题。我国研究人员研制的利用低品位软锰矿浆(主要成分是MnO2)吸收废渣高温焙烧产生的SO2,制备硫酸锰的生产流程如下:
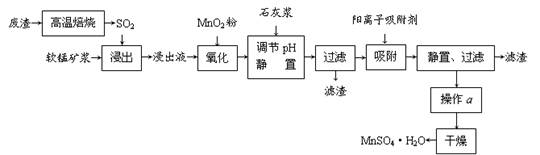
浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。
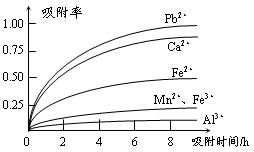
有关金属离子的半径以及形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
离子
| 离子半径(pm)
| 开始沉淀时的pH
| 完全沉淀时的pH
|
Fe2+
| 74
| 7.6
| 9.7
|
Fe3+
| 64
| 2.7
| 3.7
|
Al3+
| 50
| 3.8
| 4.7
|
Mn2+
| 80
| 8.3
| 9.8
|
Pb2+
| 121
| 8.0
| 8.8
|
Ca2+
| 99
| -
| -
|
?
已知PbO2的氧化性大于MnO2。请回答下列问题:
⑴ 写出浸出过程中主要反应的化学方程式?,氧化过程中主要反应的离子方程式?。
⑵ 在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至?。
⑶ 阳离子吸附剂用于除去杂质金属离子。决定阳离子吸附剂吸附效果的因素是?(填写序号)。
a.溶液的pH?b.金属离子的电荷?c.金属离子的半径?d.吸附时间
⑷ 操作a包括?等过程。
参考答案:
⑴ SO2+MnO2=MnSO4?2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O
⑵ 4.7~8.3
⑶ b c d
⑷ 蒸发浓缩结晶
本题解析:
本题以制备硫酸锰的生产流程为知识载体,考查化学反应的书写,及除杂中的问题。(1)从流程图看,浸出过程是软锰矿浆(MnO2)与SO2的反应。杂质离子中只有Fe2+具有还原性,可以被MnO2在酸性条件下氧化成Fe3+。(2)杂质中含有Fe2+、Al3+、Ca2+、Pb2+四种阳离子,由沉淀的pH范围知,Fe2+的沉淀与Mn2+离子的沉淀所需的pH接近,而Fe3+则相差很远,故可以将Fe2+氧化成Fe3+而除杂。从吸附率的图可以看出,Ca2+、Pb2+的吸附率较高,故只要调节pH值在4.7~8.3间,大于4.7可以将Fe3+和Al3+除去,小于8.3是防止Mn2+也沉淀。(3)结合半径,分析右图知,图中离子从上至下,半径有减小趋势,对应的吸附率减小。随着时间的递增,所有离子的吸附率均增大;另Fe3+和Al3+离子所带电荷数大,其吸附率低。(4)由于制取的MnSO4·H2O含有结晶水,故采用蒸发浓缩结晶的方法。
本题难度:一般
2、选择题 下列措施符合“绿色化学”思想的是
[? ]
A.直接排放含磷生活污水
B.大量使用氟里昂作为冰箱制冷剂
C.使用可降解塑料代替不可降解塑料
D.使用化学性质稳定、不易分解的有机氯农药
参考答案:C
本题解析:
本题难度:简单
3、实验题 今用铝、稀硫酸和氢氧化钠溶液为原料,在实验室制备一定量的氢氧化铝。可分别采用如下化学方程式所表示的两种方法:
①2Al+3H2SO4=Al2(SO4)3 +3H2↑
Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4
②2Al+2NaOH +2H2O=2NaAlO2 +3H2↑
2NaAlO2+ H2SO4+ 2H2O=2Al(OH)3↓+Na2SO4
(1)上述哪一种方法比较节约试剂[提示:试从每生产2 mol Al(OH)3所耗费的试剂用量予以说明]
(2)原料相同,请设计一种更为节约试剂的方法(说明其可以节约试剂的根据)。
参考答案:(1)后一种方法比较节约试剂。
(2)用2 mol Al中的0.5 mol Al与H2SO4反应(消耗 mol H2SO4)生成0.5 mol Al3+;
mol H2SO4)生成0.5 mol Al3+;
用2 mol Al中的1.5 mol Al与NaOH 反应(消耗1.5 mol NaOH)生成1.5 mol AlO2-;
二者混合生成 2 mol Al(OH)3。
本题解析:
本题难度:一般
4、选择题 下列变化不属于化学变化的是
A.溶洞的形成过程
B.物质的燃烧
C.合成高分子材料
D.矿石的粉碎
参考答案:D
本题解析:在溶洞的形成过程中,CaCO3变为Ca(HCO3)2,部分Ca(HCO3)2随水流走,部分Ca(HCO3)2又变为CaCO3,形成了石笋、石柱和钟乳石,是化学变化。物质的燃烧,一般是物质跟空气中的氧气发生的反应,有新的物质生成,属于化学变化。合成高分子材料属人工合成新物质,也是化学变化。矿石的粉碎过程中无新物质生成,属物理变化,不是化学变化。
本题难度:简单
5、填空题 如图是现今常规生产发烟硫酸和硫酸的流程图:
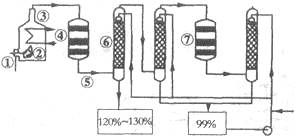
(1)在④处二氧化硫被氧化成三氧化硫,④的设备名称是?,该处发生反应的方程式为?,为提高三氧化硫的产率,该处应采用?(填“等温过程”或“绝热过程”)为宜。
(2)在⑦处进行二次催化处理的原因是?。
(3)⑤处气体混合物主要是氮气和三氧化硫.此时气体经过⑥后不立即进入⑦是因为?。
(4)20%的发烟硫酸(SO3的质量分数为20%)1吨需加水?吨(保留2位有效数字)才能配制成98%的成品硫酸。
(5)在②处发生1500℃的“不完全燃烧”,即先混入少量干燥空气,然后在③处于700℃下再继续燃烧.试简述这种燃烧方式对环境保护是有利的原因??。
参考答案:(1)接触室?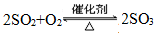 ,等温过程;
,等温过程;
(2)反应是可逆反应,二次催化使尚不未反应的SO2尽量催化氧化成SO3,可以降低成本,提高原料的利用率和保护环境;
(3)通过吸收塔后,混合气体中SO3含量较多,不利于SO2的催化氧化反应进行。
(4)0.066?
(5)在高温下空气的氮气和氧气反应生成氮氧化物,有污染;低温下氮氧化物被还原生成N2,对环境保护有利。
本题解析:(1)二氧化硫被氧化成三氧化硫的设备为接触室;SO2和O2反应生成SO3,该反应正反应方向是是可逆反应,温度过高平衡逆向移动,不利于 SO3 的生成,且影响催化剂的活性,所以采用等温过程。
(2)通过一次催化炉不可能将二氧化硫全部氧化成三氧化硫,为充分利用原料,所以设置二次催化炉,使尚未反应的二氧化硫尽量氧化成三氧化硫,这样对降低成本和环境的保护是有利的。
(3)⑤处中的混合气体主要是三氧化硫和氮气,以及少量的二氧化硫,通过口吸收塔⑥后,只能吸收一部分三氧化硫。若将这种含三氧化硫较多,二氧化硫含量较少的混合气体直接通入第二个催化炉⑦,这时带入催化剂表面的三氧化硫的分压较高,二氧化硫分压较低,不利于反应的进行。
(4)SO3+H2O=H2SO4,需要水的质量为m(H2O)=1t×20%×18/80=0.045t,浓硫酸中含水的质量为(0.8t+0.2t×98/80) ×2%=0.0209t,所以需要水的质量是0.045t+0.0209=0.066t。
(5)在高温下,1500℃,空气的氮气和氧气反应生成氮氧化物,有污染;低温下,如700℃,氮氧化物被还原,生成N2,对环境保护有利。
本题难度:一般