微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去).实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此得出的结论是浓硝酸的氧化性强于稀硝酸.
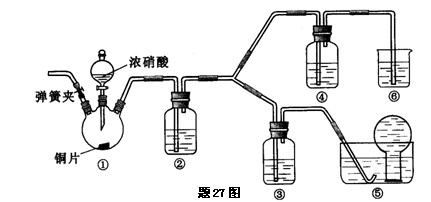
可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应.2NO2+2NaOH=NaNO3+NaNO2+H2O (1)装置①中发生反应的离子方程式是?.
(2)装置②的目的是?,发生反应的化学方程式是??.
(3)实验应避免有害气体排放到空气中,装置③、④、⑤、⑥中盛放的药品依次是
?.
(4)实验的具体操作是:先检验装置的气密性,再加入药品,然后打开弹簧夹,通入
?目的是?.
(5)该小组得出的结论所依据的实验现象是?.
2、选择题 金属钠不仅能跟氧气、水等无机物反应,还能跟酒精、醋酸等有机物反应.要研究金属钠跟酒精反应的性质以及它与水反应的异同点,下列研究方法中没有用到的是( )
A.实验法
B.观察法
C.分类法
D.比较法
3、实验题 (13分)I.某校化学实验小组探究浓度对化学反应速率的影响,并测定(NH4)2S2O8和KI反应的化学反应速率。进行如下实验探究:
【实验原理】
(NH4)2S2O8和KI反应的离子方程式为:S2O82-+ 2I-= 2SO42-+ I2?(1)
平均反应速率的计算式为v(S2O82-)=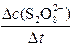 。
。
实验时,向KI、Na2S2O3和淀粉指示剂混合溶液中加入(NH4)2S2O8溶液,不断搅拌。
在反应(1)进行的同时,发生反应:2S2O32-+ I2 ="?" S4O62-+ 2I-?(2)
反应(1)生成的I2立即与S2O32-反应,生成无色的S4O62-和I-。S2O32-耗尽时,反应(1)继续生成的I2才与淀粉作用呈现蓝色。从加入(NH4)2S2O8溶液到出现蓝色的时间为Δt。
【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
实?验?编?号
| ①
| ②
| ③
| ④
| ⑤
|
?
试剂
用量
(mL)
| 0.20? mol·L-1(NH4)2S2O8溶液
| 20.0
| 10.0
| ?b
| 20.0
| 20.0
|
0.20? mol·L-1 KI溶液
| 20.0
| 20.0
| 20.0
| 10.0
| 5.0
|
0.010? mol·L-1 Na2S2O3溶液
| ?a
| 8.0
| 8.0
| 8.0
| 8.0
|
0.2% 淀粉溶液
| 2.0
| 2.0
| 2.0
| 2.0
| 2.0
|
0.20? mol·L-1KNO3溶液
| 0
| 0
| 0
| 10.0
| ?c
|
0.20? mol·L-1(NH4)2SO4溶液
| 0
| 10.0
| 15.0
| 0
| 0
|
20 ℃时,反应时间Δt(s)
| 32
| 67
| 130
| 66
| 135
|
为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变
|
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是?。
(3)第①组实验的v(S2O82-)=?mol·(L·s)-1。
(4)根据上表数据分析,可以得到的结论有(写出一条即可)?
?。
II.实验小组查资料得知,向含有Na2CO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:Na2CO3 + SO2= Na2SO3 + CO2;2Na2S + 3SO2 = 2Na2SO3 + 3S↓;
Na2SO3 + S= Na2S2O3。该小组根据上述原理设计下图所示装置制备Na2S2O3。
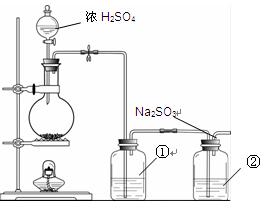
(1)实验应避免有害气体排放到空气中。装置①、②中盛放的试剂依次是
①?;
②?。
(2)实验过程中,随着气体的通入,装置①中有气泡产生,还有大量黄色固体析出,继续通入气体,可以观察到的现象是?。
(3)反应结束后,从制得的Na2S2O3稀溶液中得到Na2S2O3·5H2O晶体的主要操作包括:?。
4、实验题 在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉。这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”。请分别用下图中示意的两套仪器装置,制取上述铁的氧化物和“引火铁”。实验中必须使用普通铁粉和6 mol·L-1的盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。

图1?图2
填写下列空白:
(1)实验进行时试管A中应加入的试剂是;烧瓶B的作用是______________________;烧瓶C的作用是______________________;在试管D中收集得到的是
____________________________。
(2)实验时,U形管G中应加入的试剂是___________;长颈漏斗H中应加入___________。
(3)两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母) ___________。
(4)烧瓶I中发生的反应有时要加入少量硫酸铜溶液,其目的是__________________________。
(5)试管E中发生反应的化学方程式是______________________________________________。
(6)为了安全,在E管中的反应发生前,在F出口处必须___________;E管中的反应开始后,在F出口处应___________。
5、实验题 某铝合金中含有单质铝、镁、铜、硅,为了测定该合金中铝的含量,设计了如下实验流程,请回答有关问题:
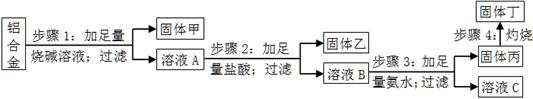
(1)步骤1所得固体甲的成分为?。
(2)步骤2中加足量盐酸,而不采用通入足量二氧化碳的原因为?。
(3)步骤3中生成固体丙的离子方程式为?;溶液C中所含有的阳离子符号为?。
(4)步骤4所发生反应的化学方程式为?。
(5)现用托盘天平称取10.0g铝合金进行上述流程图所示操作,所得固体丁质量为15.3g,则该铝合金中铝的质量分数为?;并判断以下操作对铝质量分数测定的影响(填“偏大”、“偏小”或“无影响”)。
a.步骤1中烧碱量不足,则?;
b.步骤4中灼烧不充分,则?。