微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 金刚石SiC具有优良的耐磨、耐腐蚀特性,应用广泛.
(1)碳与同周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物H为非极性分子,碳元素在周期表中的位置是,Q是,R的电子式为.
(2)一定条件下,Na还原CCl4可制备金刚石,反应结束冷却至室温后,回收CCl4的实验操作名称为,除去粗产品中少量钠的试剂为.
(3)碳还原制SiC,其粗产品中杂质为Si和SiO2.先将20.0g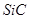 粗产品加入到过量的NaOH溶液中充分反应,收集到0.1mol氢气,过滤得SiC固体11.4g,滤液稀释到1L,生成氢气的离子方程式为,硅酸钠的物质的量浓度为
粗产品加入到过量的NaOH溶液中充分反应,收集到0.1mol氢气,过滤得SiC固体11.4g,滤液稀释到1L,生成氢气的离子方程式为,硅酸钠的物质的量浓度为
(4)下列叙述正确的有(填序号),
①Na还原CCl4的反应、Cl2与H2O的反应均是置换反应②水晶、干冰熔化时克服粒子间作用力的类型相同③Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱
④钠、锂分别在空气中燃烧,生成的氧化物中阴阳离子数目比均为1:2
参考答案:⑴第二周期第ⅣA族,氧(或O),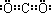 ⑵过滤,水(或乙醇)
⑵过滤,水(或乙醇)
⑶Si+2OH-+H2O=SiO32-+2H2↑,0.17mol·L-1⑷③④
本题解析:(1)由题给信息“碳与Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子”可推知Q为氧,非极性分子R为CO2.根据周期序数=电子层数,主族序数=最外层电子数可以确定碳在周期表中的位置是第二周期第ⅣA族,CO2的电子式为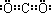 ,
,
(2)金刚石是不溶于CCl4的固体,CCl4是液体,将不溶性固体和液体分离通常采用的方法是过滤;由于Na可以与水(或乙醇)发生反应,而金刚石不与水(或乙醇)反应,所以除去粗产品中少量的钠可用水(或乙醇),
(3)根据硅与NaOH反应的化学方程式Si+2NaOH+H2O═Na2SiO3+2H2↑可写出其离子方程式为Si+2OH-+H2O═SiO32-+2H2↑;
计算溶液中硅酸盐的物质的量浓度需要根据化学方程式进行计算:
Si+2NaOH+H2O═Na2SiO3+2H2↑
28g1mol2mol
m(Si)n1(Na2SiO3)0.1mol
m(Si)=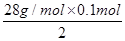 =1.4g,
=1.4g,
n1(Na2SiO3)=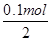 =0.05mol,
=0.05mol,
粗产品中SiO2的质量为m(SiO2)=20.0g-11.4g-1.4g=7.2g
SiO2+2NaOH═Na2SiO3+H2O
60g1mol
7.2gn2(Na2SiO3)
n2(Na2SiO3)=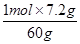 =0.12mol,
=0.12mol,
则n(Na2SiO3)=n1(Na2SiO3)+n2(Na2SiO3)=0.12mol+0.05mol=0.17mol,
硅酸盐的物质的量浓度为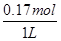 =0.17mol·L-1,
=0.17mol·L-1,
(4)①Na还原CCl4的反应属于置换反应,但Cl2与H2O反应生成HCl和HClO,不是置换反应,①错误;
②水晶属于原子晶体,而干冰属于分子晶体,熔化时克服粒子间作用力的类型不相同,②错误;③Na2SiO3溶液与SO3的反应,说明酸性H2SiO3比H2SO4弱,则可用于推断Si与S的非金属性强弱,③正确;
④钠、锂分别在空气中燃烧,生成的氧化物分别为Na2O2、Li2O,阴阳离子数目比均为1:2,④正确.
本题难度:一般
2、填空题 有A、B、C三种透明、不溶于水的坚硬固体。A在O2中完全燃烧只得到一种无色气体,此气体的密度为O2密度的1.375倍(标准状况)。B能溶于热烧碱溶液中,再往该溶液中加入过量盐酸时,析出白色胶状沉淀,它是一种比碳酸还弱的酸,分离出此沉淀物,经干燥后得到不溶于水的白色粉末,将B与石灰石、纯碱按一定比例混合高温烧熔、冷却得C,C在高温下软化,无固定熔点。根据以上事实,推断:
(1)A是________,B是________,C是________。
(2)写出有关反应的化学方程式________________________________。
参考答案:(1)金刚石晶体?二氧化硅晶体?玻璃
(2)C+O2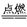 CO2?SiO2+2NaOH
CO2?SiO2+2NaOH Na2SiO3+H2O
Na2SiO3+H2O
Na2SiO3+2HCl H2SiO3↓+2NaCl
H2SiO3↓+2NaCl
CaCO3+SiO2 CaSiO3+CO2↑
CaSiO3+CO2↑
Na2CO3+SiO2 Na2SiO3+CO2↑
Na2SiO3+CO2↑
本题解析:A完全燃烧所得气体的相对分子质量为:32×1.375=44,即该气体为CO2,A为C元素的单质,依A的性能知A为金刚石,依据B的性质及所发生的一系列反应和反应产物的性质推知B为SiO2晶体,则C为玻璃。
本题难度:简单
3、选择题 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合下图。则甲和X(要求甲和X能互换)不可能是

[? ]
A.C和O2
B.SO2和NaOH溶液
C.Cl2和Fe
D.AlCl3溶液和NaOH溶液
参考答案:C
本题解析:
本题难度:简单
4、选择题 地壳中含量第一和第二的两元素形成的化合物,不具有的性质是? ( )。
A.在一定条件下可与NaOH溶液反应
B.与碳在高温下反应可制取两元素中的一种单质
C.熔点很高,可用作耐火材料
D.是酸酐,与水反应生成相应的酸
参考答案:D
本题解析:地壳中含量第一和第二的两种元素分别是氧和硅,形成的主要化合物是SiO2,SiO2是硅酸(H2SiO3)和原硅酸(H4SiO4)的酸酐,但不与水直接反应。
本题难度:一般
5、填空题 (15分)(2012?重庆)金刚石、SiC具有优良的耐磨、耐腐蚀特性,应用广泛.
(1)碳与短周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子.碳元素在周期表中的位置是?,Q是?,R的电子式为?.
(2)一定条件下,Na还原CCl4可制备金刚石,反应结束冷却至室温后,回收其中的CCl4的实验操作名称为?,除去粗产品中少量钠的试剂为?.
(3)碳还原SiO2制SiC,其粗产品中杂质为Si和SiO2.现将20.0g SiC粗产品加入到过量的NaOH溶液中充分反应,收集到0.1mol氢气,过滤得SiC固体11.4g,滤液稀释到1L.生成氢气的离子方程式为?,硅酸盐的物质的量浓度为?.
(4)下列叙述正确的有?(填序号).
①Na还原CCl4的反应、Cl2与H2O的反应均是置换反应
②水晶、干冰熔化时克服粒子间作用力的类型相同
③Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱
④钠、锂分别在空气中燃烧,生成的氧化物中阴阳离子数目比均为1:2.
参考答案:(1)第二周期第ⅣA族;氧(或O);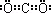 ;(2)过滤;水(或乙醇)(3)Si+2OH﹣+H2O═SiO32﹣+2H2↑;0.17 mol?L﹣1(4)③④
;(2)过滤;水(或乙醇)(3)Si+2OH﹣+H2O═SiO32﹣+2H2↑;0.17 mol?L﹣1(4)③④
本题解析:(1)Q为氧,非极性分子R为CO2;
(2)将不溶性固体和液体分离通常采用的方法是过滤;由于Na可以与水(或乙醇)发生反应;
(3)根据反应的方程式计算生成Na2SiO3的物质的量,进而计算浓度;
(4))①Na还原CCl4的反应属于置换反应,但Cl2与H2O反应生成HCl和HClO;
②水晶属于原子晶体,而干冰属于分子晶体;
③元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
④钠、锂分别在空气中燃烧,生成的氧化物分别为Na2O2、Li2O.
解:(1)由题给信息“碳与Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子”可推知Q为氧,非极性分子R为CO2.根据周期序数=电子层数,主族序数=最外层电子数可以确定碳在周期表中的位置是第二周期第ⅣA族,CO2的电子式为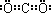 ,故答案为:第二周期第ⅣA族;氧(或O);
,故答案为:第二周期第ⅣA族;氧(或O);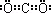 ;
;
(2)金刚石是不溶于CCl4的固体,CCl4是液体,将不溶性固体和液体分离通常采用的方法是过滤;由于Na可以与水(或乙醇)发生反应,而金刚石不与水(或乙醇)反应,所以除去粗产品中少量的钠可用水(或乙醇),
故答案为:过滤;水(或乙醇);
(3)根据硅与NaOH反应的化学方程式Si+2NaOH+H2O═Na2SiO3+2H2↑可写出其离子方程式为Si+2OH﹣+H2O═SiO32﹣+2H2↑;
计算溶液中硅酸盐的物质的量浓度需要根据化学方程式进行计算:
Si+2NaOH+H2O═Na2SiO3+2H2↑
28 g? 1 mol? 2 mol
m(Si)? n1(Na2SiO3) 0.1 mol
m(Si)=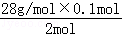 =1.4g,
=1.4g,
n1(Na2SiO3)=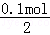 ="0.05" mol,
="0.05" mol,
粗产品中SiO2的质量为m(SiO2)=20.0g﹣11.4g﹣1.4 g="7.2" g
SiO2+2NaOH═Na2SiO3+H2O
60g? 1mol
2g? n2(Na2SiO3)
n2(Na2SiO3)=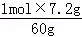 =0.12mol,
=0.12mol,
则n(Na2SiO3)=n1(Na2SiO3)+n2(Na2SiO3)=0.12mol+0.05mol=0.17mol,
硅酸盐的物质的量浓度为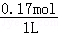 =0.17mol/L,
=0.17mol/L,
故答案为:Si+2OH﹣+H2O═SiO32﹣+2H2↑;0.17 mol?L﹣1;
(4)①Na还原CCl4的反应属于置换反应,但Cl2与H2O反应生成HCl和HClO,不是置换反应,故①错误;
②水晶属于原子晶体,而干冰属于分子晶体,熔化时克服粒子间作用力的类型不相同,故②错误;
③Na2SiO3溶液与SO3的反应,说明酸性H2SiO3比H2SO4弱,则可用于推断Si与S的非金属性强弱,故③正确;
④钠、锂分别在空气中燃烧,生成的氧化物分别为Na2O2、Li2O,阴阳离子数目比均为1:2,故④正确.
故答案为:③④.
点评:本题综合元素化合物知识,题目难度中等,注意从质量守恒的角度结合反应的化学方程式计算,(3)为易错点.
本题难度:一般