微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关实验原理,方法和结论都正确的是?( ?)
A.某钠盐溶液中加入盐酸酸化的硝酸钡溶液有白色沉淀,该钠盐一定是硫酸钠
B.在硫酸钡中加入足量饱和Na2CO3溶液,振荡、过滤、洗涤,沉淀中加入盐酸有气体产生,说明K10(H2SO4)>K10(BaCO3)
C.新制氯水中加入碳酸钙粉末搅拌,过滤、滤液中c(HC1O)将增大
D.相同质量的两份锌粒分别加入足量稀硫酸,在一份中加入少量CuSO4·5H2O,其反应速率将加快,且最终产生的H2与另一份相同
参考答案:C
本题解析:

本题难度:简单
2、选择题 己知:Cu+2Fe3+=2Fe2++Cu2+。现把相同物质的量的CuSO4、 FeCl3和Zn置于ii 中充分反应,反应器中所得混合物除含有SO42-和Cl-外,还含有
A.Zn2+、Cu、Fe3+
B.Zn、Cu2+、Fe3+
C.Zn2+、Cu、Cu2+、Fe2+
D.Zn2+,Cu2+、Fe、Fe2+
参考答案:C
本题解析:由离子方程式Cu+2Fe3+=2Fe2++Cu2+可知,氧化性强弱关系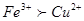 ,设它们的物质的量均为2mol,则第一步反应为
,设它们的物质的量均为2mol,则第一步反应为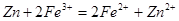 ,2mol
,2mol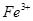 需消耗1molZn,第二步反应为
需消耗1molZn,第二步反应为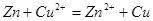 ,余下1mol锌只能消耗1mol
,余下1mol锌只能消耗1mol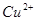 ,还有1mol
,还有1mol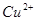 没有反应,所以正确选项为C;
没有反应,所以正确选项为C;
本题难度:一般
3、选择题 下列说法正确的是( )
A.pH=3的溶液中,Na+、Cl-、Fe2+、ClO-能大量共存
B.使石蕊变红的溶液中,Na+、I-、Cl-、NO3-、C6H5O-能大量共存
C.Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)
D.室温下,向0.01mol/LNH4HSO4溶液中滴加NaOH溶液至中性,混合溶液中:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
参考答案:A、pH=3的溶液中存在大量的H+,H+、Fe2+、ClO-能发生氧化还原反应,则离子不能大量共存,故A错误;
B、使石蕊变红的溶液显酸性,H+、I-、NO3-能发生氧化还原反应,H+、C6H5O-能结合生成弱电解质,则离子不能大量共存,故B错误;
C、Na2CO3溶液中电荷守恒式为c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),物料守恒式为12c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),
则c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3),故C正确;
D、NH4HSO4与NaOH的物质的量之比为1:1时溶液显酸性,NH4HSO4与NaOH的物质的量之比为1:2时溶液显碱性,则0.01mol/LNH4HSO4溶液中滴加NaOH溶液至中性,
NH4HSO4与NaOH的物质的量之比应大于1:1,小于1:2,此时溶液为硫酸钠、硫酸铵、氨水的混合溶液铵根离子的水解与氨水的电离程度相等,c(OH-)=c(H+),
由反应的物质的量可知c(Na+)>c(SO42-)>c(NH4+),故D正确;
故选CD.
本题解析:
本题难度:一般
4、选择题 下列溶液中的离子一定能大量共存是( )
A.含有大量OH-的溶液:Na+、K+、NO3-、CO32-
B.含有大量H+的溶液:HCO3-、K+、SO42-、Cl-
C.含大量Fe3+的溶液:NH4+、Na+、SCN-、OH-
D.含有大量CO32-的溶液:Ca2+、Na+、NO3-、SO42-
参考答案:A、Na+、K+、NO3-、CO32-离子之间不反应,也不与OH-反应,在溶液中能够大量共存,故A正确;
B、HCO3-能够与H+离子反应,在溶液中不能大量共存,故B错误;
C、Fe3+能够与SCN-、OH-反应,在溶液中不能大量共存,故C错误;
D、CO32-能够与Ca2+、SO42-反应,在溶液中不能大量共存,故D错误;
故选A.
本题解析:
本题难度:简单
5、选择题 常温下,下列各组离子在有一定关限定条件下的溶液中一定能大量共存的是
A.由水电离产生的c(H+)=10-12 mol·L一1的溶液中:K+、Na+、Fe2+、NO3-
B.常温下,pH=7的溶液中: Al3+、Cl-、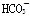 、SO42-
、SO42-
C.常温下,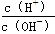 =1×10-12的溶液:K+、Cu2+、S2-、Cl-
=1×10-12的溶液:K+、Cu2+、S2-、Cl-
D.pH=13的溶液中:K+、Ba2+ 、Cl-、OH-