A的质量分数
参考答案:C
本题解析:略
本题难度:一般
3、填空题 在稀氨水中存在平衡:NH3+H2O NH NH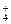 +OH-,如进行下列操作,则NH3、NH +OH-,如进行下列操作,则NH3、NH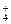 、H+、OH-浓度及PH值如何变化?(试用“增大”“减小”“不变”填写。)(1)通适量HCl气体时,c(NH3)?,c(H+)?,PH值?。 、H+、OH-浓度及PH值如何变化?(试用“增大”“减小”“不变”填写。)(1)通适量HCl气体时,c(NH3)?,c(H+)?,PH值?。
(2加入少量NaOH固体时,c(NH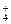 )?,c(OH-)?,PH值?。 )?,c(OH-)?,PH值?。
(3)加入NH4Cl晶体时,c(NH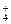 )?,c(OH-)?。 )?,c(OH-)?。
参考答案:(1)c(NH3)?减小?,c(H+)?增大?,PH值?减小??
(2 c(NH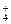 )?减小?,c(OH-)?增大?,PH值?增大 )?减小?,c(OH-)?增大?,PH值?增大
(3)c(NH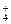 )?增大?,c(OH-)?减小?。 )?增大?,c(OH-)?减小?。
本题解析:略
本题难度:简单
4、选择题 如图,隔板K可左右移动,甲中充入2 mol A和1 mol B,乙中充入2 mol C和1 mol He,此时K停在0处。发生反应2A(g)+B(g)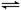 2C(g),达到平衡后,恢复至温度。下列有关说法不正确的是 2C(g),达到平衡后,恢复至温度。下列有关说法不正确的是
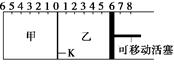
A.达平衡后,隔板K最终停留在左侧刻度0~2之间
B.若平衡时K停留在左侧1处,则活塞停留在右侧6处
C.达到平衡时,甲容器中B的物质的量小于于乙容器中B的物质的量
D.根据隔板K滑动与否可判断左右两边的反应是否达到平衡
参考答案:B
本题解析:反应是体积减小的可逆反应,所以在反应过程中乙中气体的物质的量增加,甲中气体的物质的量减少,因此K向作移动。由于是可逆反应,所以甲中气体的物质的量一定大于2mol,因此隔板K最终停留在左侧刻度0~2之间,A正确。乙容器相当于在甲容器的基础上,平衡时通入稀有气体,在压强不变的情况下,平衡向生成A、B的方向移动,所以选项C正确。当K不再滑动时,说明反应达到平衡状态,D正确。若平衡时K停留在左侧1处,则乙中气体的物质的量变化量大于1个单位,所以B不正确,答案选B。
本题难度:一般
5、选择题 已知反应3X(g)+Y(g) 2Z(g)? ΔH>0,T℃时化学平衡常数K = 2,在密闭容器中反应达到平衡,下列说法正确的是(?) 2Z(g)? ΔH>0,T℃时化学平衡常数K = 2,在密闭容器中反应达到平衡,下列说法正确的是(?)
A.升高温度平衡常数K减小
B.若压缩体积,平衡向气体体积增大方向移动,混合气体的平均相对分子质量减小
C.保持体积不变,通入稀有气体,压强增大,平衡向正反应方向移动
D.T℃时,向2L密闭容器中加入 2molX、3molY、4molZ,反应将向左进行
参考答案:D
本题解析:考查条件变化对化学平衡反应的影响。ΔH>0,该反应为吸热反应,升高温度,平衡向正反应方向(吸热)移动,K增大,A错误;压缩体积,压强增大,平衡向气体体积减小的方向移动(正方向),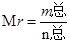 ,根据质量守恒定律,m总不变,n总减小,Mr增大,B错误;保持体积不变,温度不变,通入稀有气体,压强增大,但反应气体产生的分压不变,即反应物和生成物的浓度不变,不影响化学反应速率,正负反应速率仍相等,平衡不移动,C错误; ,根据质量守恒定律,m总不变,n总减小,Mr增大,B错误;保持体积不变,温度不变,通入稀有气体,压强增大,但反应气体产生的分压不变,即反应物和生成物的浓度不变,不影响化学反应速率,正负反应速率仍相等,平衡不移动,C错误;
本题难度:简单
|