微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 在标准状况下进行下列实验:甲、乙各取?30.0ml同浓度的盐酸,加入同一镁-铝合金粉末产生气体,有关数据列表如下:
| 实验序号 | 甲 | 乙 | 丙
合金质量/mg
255
385
510
气体体积/ml
280
336
336
|
(1)盐酸的物质的量浓度为______?mol/L,在表中可作为计算依据的是______?(填实验序号,符合要求的全部写出)
(2)据______(填实验序号)中的数据,可计算此镁-铝合金中镁与铝的物质的量之比______.
(3)在乙实验中,可以判断______
A、金属过量?B、恰好反应?C、金属不足?D、无法判断
(4)在丙实验之后,向容器中加入一定量的1.00mol/l的NaOH溶液能使合金中的铝粉恰好完全溶解,再过滤出不溶性的固体,请填下表:
| 滤液中的溶质 | NaCl | NaAlO2
对应物质的量/mol
加入NaOH溶液的体积/ml |
2、简答题 铝镁合金现已成为轮船制造、化工生产等行业的重要原料.现有一块铝镁合金,欲测定其中镁的质量分数,几位同学分别称取3.9克样品,并设计了不同的实验方案:
甲:铝镁合金 测得生成气体的体积Vml(已折算成标准状况);
乙:铝镁合金→测得剩余固体的质量a克;
丙:铝镁合金?溶液??测得沉淀的质量2.9克.
(1)写出实验设计甲有关反应的离子方程式:______;该方案能否测定出镁的质量分数?______(填“能”或“不能”)
(2)实验设计乙所加入的试剂是______,测得的镁的质量分数为______
(3)实验设计丙中加过量的NaOH溶液充分反应后,______(填一种分离方法),洗涤烘干沉淀,测得镁的质量分数为(保留小数点后一位小数)______,如果未洗涤沉淀,测得镁的质量分数将______(填“偏大”、“偏小”或“无影响”).
3、实验题 (15分)有甲、乙两个探究性学习小组,他们拟用小颗粒状铝硅合金与足量稀硫酸的反应测定通常状况(约20℃,1atm)下气体摩尔体积的方法。
(1)甲组同学拟选用图27题-l的实验装置完成实验:
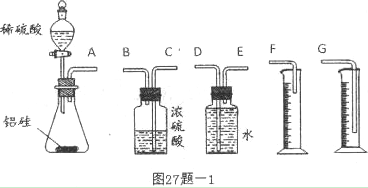
①铝硅合金与足量稀硫酸的反应的离子方程式__________________________________。
②该组同学必须选用的装置的连接顺序是A接(? )(? )接(? )(? )接(? )(填接口字母,可不填满。)
③实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,过一会儿后稀硫酸就不能顺利滴入锥形瓶。请你帮助分析原因_________________________________________
_____________ _______________________________________________________________。 _______________________________________________________________。
④实验结束时,测量实验中生成氢气的体积时应注意:a.待实验装置
冷却到(约20℃,1atm)后,上下移动量筒,使其中液面与广口瓶中
液面相平,b.______________________________________。
(2)乙组同学仔细分析甲组同学的实验装置后,认为:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了图27题-2所示的实验装置。
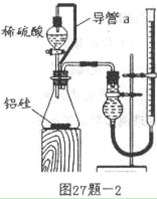
装置中导管a的作用是
_________________________ ___________________________ ___________________________
_____________________________________________________。
②实验中准确测得4个数据:实验前铝硅合金的质量m1g,实验后残留固体的质量m2g,实验前后碱式滴定管中液面读数分别为V1mL、V2mL。则通常状况时气体摩尔体积Vm=_______L·moL-1。
4、填空题 将一定质量的镁铝合金样品全部溶于100mL某浓度的盐酸中。向所得溶液中滴加5.0mol/L的NaOH溶液,生成沉淀质量与加入的NaOH溶液体积关系如右图所示。求:
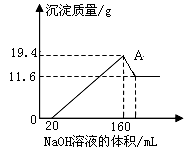
(1)A点沉淀物的化学式为 _?。
(2)原合金中的Mg 、Al质量各多少克?
(3)盐酸的物质的量浓度。
5、选择题 将钠、铝混合物(质量A1g)投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体7.84L.向溶液中逐滴加入浓度为2mol?L-1的H2SO4溶液,至100ml时白色沉淀达到最大量.继续滴入H2SO4溶液,当加入H2SO4溶液的体积为xml时沉淀恰好消失.将所得溶液蒸干灼烧得固体A2g.下列关系式中不正确的是( )
A.沉淀达到最大量时溶液中的溶质为Na2SO4、NaHSO4
B.x=75ml
C.A1=11.9
D.白色沉淀最大量为7.8g
|