微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式中,不正确的是?( )
A.向FeBr2溶液中通入少量的Cl2:2Fe2++Cl2=2Fe3++2Cl-
B.向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-反应完全
2Ba2++4OH-+Al3++2SO42-
C.向Mg(HCO3)2溶液中加入过量的 NaOH溶液
Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O
D.向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-
参考答案:B
本题解析:略
本题难度:一般
2、选择题 向FeI2和FeBr2物质的量之比为2:3的混合溶液中逐滴滴入氯水,下列离子反应可能发生的是
A.10Fe2+ + 8I-+4Br-+11Cl2 →10Fe3+ +4I2+2Br2+22Cl-
B.2Fe2+ +2I-+2Cl2 →2Fe3+ +I2+4Cl-
C.6Fe2+ +4I-+5Cl2 →6Fe3+ +2I2+10Cl-
D.6Fe2+ + 2I-+6Br-+7Cl2 →6Fe3+ +I2+3Br2+14Cl-
参考答案:AB
本题解析:离子的还原性强弱顺序是I->Fe2+>Br-,所以选项AB正确。C中亚铁离子和碘离子的物质的量之比是3︰2的,而原溶液中亚铁离子和碘离子的物质的量之比是5︰4,所以C是错误的。同样D中亚铁离子和碘离子的物质的量之比是3︰1的,也是错误的,答案选AB。
本题难度:一般
3、选择题 下列离子方程式正确的是
[? ]
A.在稀氨水中通入少量CO2:NH3·H2O+CO2===NH4++HCO3-
B.向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C.过量的NaHSO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+2H2O
D.在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
参考答案:D
本题解析:
本题难度:一般
4、选择题 有些化学反应不论反应物量的多少,都只能用同一个离子方程式来表示。下列各组在溶液中的反应不符合这一情况的是(?)
A.Ba(OH)2与H2SO4
B.KMnO4和H2O2
C.HCl与NaHCO3
D.Ca(HCO3)2与Ca(OH)2
参考答案:B
本题解析:A、不论Ba(OH)2和H2SO4的量的多少,二者反应的离子方程式只有一个:Ba2++2OH?+2H++SO42?=BaSO4↓+2H2O;B、KMnO4能将H2O2氧化为O2,随着H2O2的增加,H2O2可分解为H2O和O2,可得出多个离子方程式;C、不论反应物的量怎样变化,HCl与NaHCO3反应的离子方程式只有一个:H++HCO3?=CO2↑+H2O;D、不论反应物的量怎样变化,Ca(HCO3)2与Ca(OH)2反应的离子方程式只有一个:Ca2++HCO3?+OH?=CaCO3↓+H2O。
本题难度:一般
5、填空题 【化学–选修2:化学与技术】(15分)
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O),是重要的化工产品和强氧化剂。工业制备红矾钠的流程如下:
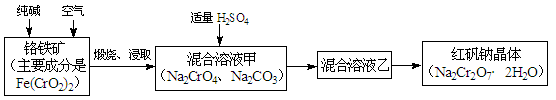
(1)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成?。
(2)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:4Fe(CrO2)2+8Na2CO3+7O2 = 2Fe2O3+8Na2CrO4+8CO2。为了加快该反应的反应速率,可采取的措施是?。(写一种即可)
(3)已知CrO42-在不同的酸性溶液中有不同的反应,如:
2CrO42-+2H+= Cr2O72-+H2O;? 3CrO42-+4H+= Cr3O102-+2H2O
① 往混合溶液甲中加入硫酸必须适量的原因是?。
② 混合溶液乙中溶质的化学式是?。
(4)在含Cr2O72-废水中存在着平衡:Cr2O72-+H2O 2CrO42-+2H+,请写出该平衡的平衡常数表达式K=?,若继续加水稀释,平衡将?移动(填“正向”、“逆向”“不”)。
2CrO42-+2H+,请写出该平衡的平衡常数表达式K=?,若继续加水稀释,平衡将?移动(填“正向”、“逆向”“不”)。
(5)请配平碱性溶液还原法中发生的离子反应:
□Cr2O72-+□S2-+□H2O ——□Cr(OH)3+□S2O32-+□OH-
参考答案:(15分)(1)FeO·Cr2O3(2分)
(2)粉碎矿石、升高温度(2分)
(3)① 少量不能除尽Na2CO3等杂质,过量会生成Na2Cr3O10等副产物。(2分)
② Na2Cr2O7和Na2SO4(2分)
(4)c(CrO42-)2c(H+)2/c(Cr2O72-) (2分)?正向(2分)
(5) 4? 6? 19? 8? 3? 14?(3分)
本题解析:(1)根据元素的化合价,把盐写成氧化物的形式,中间用·连接,Fe(CrO2)2中Fe为+2价,对应氧化物为FeO,Cr为+3价,对应氧化物为Cr2O3,所以Fe(CrO2)2的氧化物形式为FeO·Cr2O3;
(2)考虑综合效益,加快反应速率,可以升高温度或把矿石粉碎;
(3)① 加硫酸的目的是除去杂质碳酸钠,少量不能除尽Na2CO3等杂质,过量会生成Na2Cr3O10等副产物,所以加入硫酸必须适量;
②因为最终得到的晶体是Na2Cr2O7·2H2O,所以混合溶液乙中的溶质是Na2Cr2O7及Na2SO4;
(4)根据化学平衡常数的表达式,Cr2O72-+H2O 2CrO42-+2H+平衡常数K=c(CrO42-)2c(H+)2/c(Cr2O72-) ;加水稀释,反应物、生成物的浓度均减小,但生成物的浓度幂之积减小的更多,平衡正向移动;
2CrO42-+2H+平衡常数K=c(CrO42-)2c(H+)2/c(Cr2O72-) ;加水稀释,反应物、生成物的浓度均减小,但生成物的浓度幂之积减小的更多,平衡正向移动;
(5)根据得失电子守恒法配平方程式,Cr2O72-中Cr为+6价,产物Cr(OH)3中Cr为+3价;反应物中S元素的化合价为-2价,产物中S元素的化合价为+2价,Cr2O72-中Cr整体降6价,S整体升高8价,6、8的最小公倍数是24,所以6×4,Cr2O72-前的系数是4,Cr(OH)3前的系数是8;8×3,所以S2O32-前的系数是3,S2-前的系数是6,根据电荷守恒配平OH-的系数是14,观察法配平H2O的系数是19,所以答案是 4? 6? 19? 8? 3? 14 。
本题难度:一般