微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列操作错误的是
A.用硫粉覆盖撒落在地面的汞
B.用二氧化碳扑灭金属钠引起的火灾
C.用热碱溶液洗去试管内壁的硫
D.用湿的红色石蕊试纸检验氨气是否集满
参考答案:B
本题解析:分析:A.汞为重金属,能使蛋白质发生变性,汞挥发会对人体造成危害,汞可与硫反应生成HgS;
B.钠着火时生成过氧化钠,而过氧化钠能与二氧化碳发生反应生成氧气,则不能使用二氧化碳来扑灭金属钠着火;
C.硫可以和热碱溶液发生歧化反应,生成可溶于水的硫化物;
D.显碱性的物质都能使湿润的红色石蕊试纸变蓝色;
解答:A.硫与汞反应的化学方程式为:Hg+S=HgS,生成的硫化汞(HgS)为固体,所以用硫粉覆盖撒落在地面的汞,可防止汞重金属挥发,使人体蛋白质发生变性,造成危害,故A正确;
B.钠着火时生成过氧化钠,过氧化钠与二氧化碳发生反应生成碳酸钠和氧气,2Na2O2+2CO2=2Na2CO3+O2,氧气具有助燃性,所以用二氧化碳扑灭金属钠引起的火灾使火灾更大,故B错误;
C.试管内壁的硫用热碱溶液洗,硫可以和热碱溶液发生歧化反应3S+6OH-? 2S2-+SO32-+3H2O,生成可溶于水的硫化物,故C正确;
2S2-+SO32-+3H2O,生成可溶于水的硫化物,故C正确;
D.氨气为碱性气体,显碱性的物质都能使湿润的红色石蕊试纸变蓝色,用湿润的红色石蕊试纸放在集气瓶口,湿润红色石蕊试纸变蓝色,说明已收集满氨气,所以能用湿的红色石蕊试纸检验氨气是否集满,故D正确;
故选B.
点评:本题主要考查了常见的化学基本实验操作,掌握硫、钠、氨的性质是解答的关键,题目难度不大.
本题难度:困难
2、选择题 下列除去物质杂质所选试剂或方法不正确的是
A.A
B.B
C.C
D.D
参考答案:C
本题解析:分析:A.二氧化碳与NaOH溶液反应生成碳酸钠和水;
B.杂质CuSO4与铁粉反应生成铜和硫酸亚铁;
C.氧化钙能与水发生反应生成氢氧化钙;
D.盐酸与碳酸钾反应生成氯化钾、二氧化碳和水.
解答:A.杂质二氧化碳与NaOH溶液反应生成碳酸钠和水,故A正确;
B.杂质CuSO4与铁粉反应生成铜和硫酸亚铁,过滤即可,故B正确;
C.氧化钙可与水反应生成难挥发的氢氧化钙,乙醇和氧化钙不反应,所以可用加生石灰蒸馏的方法分离,故C错误;
D.因盐酸与碳酸钾反应生成氯化钾、二氧化碳和水,二氧化碳是气体会从溶液中逸出,则不会引入杂质,得到氯化钾的溶液,再蒸发、结晶可得到氯化钾,故D正确.
故选C.
点评:本题主要主要考查了物质的除杂,题目难度不大,抓住除杂质至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质是解题的关键.
本题难度:简单
3、选择题 氧化还原反应实际上包含氧化和还原两个过程。(1)向氯酸钠(NaClO3)的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2+2H2O
参考答案:
本题解析:
本题难度:一般
4、选择题 在25℃时,某溶液中由水电离出的c(H+)=1×10-12mol/L,则该溶液的pH可能是
A.12
B.7
C.6
D.2
参考答案:AD
本题解析:
本题难度:简单
5、填空题 已知铜能被稀硝酸溶解,其反应的化学方程式如下
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
(1)用双线桥法分析上述反应的电子转移情况(只需标出电子得失的方向和数目)__________________________________________________________________。
(2)上述反应中氧化剂是 ,氧化产物是 。
(3)上述反应中氧化剂与还原剂的物质的量之比为 。
(4)若反应中转移了0.6 mol电子,产生的气体在标准状况下的体积是 。
参考答案:(1)
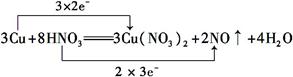
(2)HNO3 Cu(NO3)2
(3)2∶3
(4)4.48 L
本题解析:(1)在反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价由0升高到+2价,N元素的化合价由+5降低为+2价,转移的电子为6e-,
则双线桥法标出电子得失的方向和数目为 ,
,
故答案为: ;
;
(2)N元素的化合价降低,Cu元素的化合价升高,则硝酸为氧化剂,硝酸铜为氧化产物;(3)生成硝酸盐体现硝酸的酸性,生成NO体现硝酸的氧化性,由反应及氮原子守恒可知,8mol硝酸反应时6mol硝酸体现酸性,2mol硝酸体现氧化性,3mol铜体现了还原性,故氧化剂与还原剂的物质的量之比为2:3;(4)由反应可知生成2molNO转移的电子为6mol,则反应中转移了0.6mol电子,产生的气体的物质的量为0.2mol,其在标准状况下的体积为0.2mol×22.4L/mol=4.48L。
考点:氧化还原反应;硝酸的化学性质。
本题难度:一般