微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 钛(Ti)因为具有神奇的性能越来越受到人们的关注。常温下钛不和非金属、强酸反应,红热时,却可以与常见非金属单质反应。钛是航空、军事、电力等方面的必需原料。地壳中有一种含钛矿石称金红石(TiO2),目前大规模生产钛的方法是:?
(1)第一步:金红石(TiO2)、炭粉混合,在高温条件下通入Cl2制取TiCl4和一种可燃性气体。该反应的化学方程式为___________________,该反应的还原剂是___________。 ?
(2)第二步:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛。?
写出此反应的化学方程式____________________。?
如何由上述所得产物获取金属钛?简述步骤并写出有关反应的化学方程式:________。
参考答案:(1)TiO2+2C+2Cl2 TiCl4+2CO;C?
TiCl4+2CO;C?
(2)TiCl4+2Mg?=Ti+2MgCl2;加入足量的盐酸除去过量的镁,过滤,并用蒸馏水洗涤固体可得到金属钛,Mg+2HCl=MgCl2+H2↑
本题解析:
本题难度:一般
2、填空题 氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制流程:

根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为______________。
(2)混合①中使用冰水的目的是__________________。
(3)操作Ⅱ和操作Ⅲ的名称分别是_______?、________。操作Ⅲ一般适用于分离____________混合物。(选填编号)
a.固体和液体?b.固体和固体?c.互不相溶的液体?d.互溶的液体
(4)混合②中加入Na2SO3的目的是___________。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为__________,若假设成立可观察到的现象为_____________。乙同学假设工业氢溴酸呈淡黄色是因为________,其用于证明该假设所用的试剂_____________?。
参考答案:(1)SO2+Br2+2H2O==?2HBr+H2SO4
(2)降低体系温度,防止溴蒸发,使反应完全
(3)过滤;蒸馏;?d?
(4)除去粗品中未反应完的溴
(5)KSCN溶液;溶液变成血红色;含有Br2;CCl4
本题解析:
本题难度:一般
3、填空题 以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等。现用硫酸渣制备铁红的过程如下

(1)铁红的主要成分为__________,还原后过滤得到滤渣的主要成分为_________。
(2)酸溶过程中Fe2O3与稀硫酸反应的化学方程式是_______________________
(3)还原过程中加入FeS2是将溶液中的Fe3+还原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式
________________________
(4)氧化过程中通入空气和加入NaOH是为了将溶液中的铁元素充分转化为沉淀而析出,写出有关的离子方程式:________________________
(5)生产过程中,为了确保铁红的质量,氧化过程需要调节溶液的pH至3~4,其目的是______________。
参考答案:(1)Fe2O3;SiO2
(2)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
(3)FeS2+14Fe3++8H2O=15Fe2++2SO42-+ 16H+
(4)4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓(或Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+O2+2H2O=4Fe(OH)3)
(5)使Fe3+完全沉淀,而其他金属阳离子不生成沉淀
本题解析:
本题难度:一般
4、填空题 从废钯催化剂(该催化剂的载体为活性炭,杂质元素有铁、镁、铝、硅、铜等)中提取海棉钯(含Pd> 99.9%)的部分工艺流程如下:
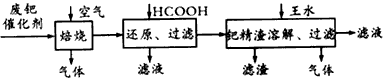
将最后所得到的滤液,经过一定的操作后可得到海棉钯。
(1)废钯催化剂经烘干后,再在800℃的高温下焙烧,焙烧过程中需通入足量空气的原因是____________;焙烧时钯转化为氧化钯(PdO),则甲酸还原氧化钯的化学方程式为_______________。
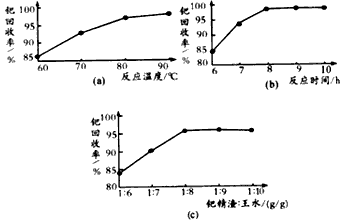
(2)钯精渣中钯的回收率高低主要取决于王水溶解的操作条件,已知反应温度、反应时间和王水用量对钯回收率的影响如图(a)所示,则王水溶解钯精渣的适宜条件为___________、__________、___________。
(3)王水是浓硝酸与浓盐酸按体积比1:3混合而成的,王水溶解钯精渣的过程中有化合物A和一种无色、有毒气体B生成,并得到滤渣。
①气体B的分子式:____________;滤渣的主要成分是______________。
②经测定,化合物A由3种元素组成,有关元素的质量分 数为Pd:42.4%,H:0.8%,则A的化学式为
________。
参考答案:(1)使活性炭充分燃烧而除去;PdO+ HCOOH = Pd+ CO2↑+ H2O
(2)80~90℃(或90℃左右);反应时间约为8h;钯精渣与王水的质量比为1:8
(3)①NO;SiO2(或其他合理答案);②H2PdCl4
本题解析:
本题难度:一般
5、填空题 Na3AlF6不溶于水,可用作胃毒性和触杀性杀虫剂,搪瓷乳白剂、树脂橡胶的耐磨填充剂,并广泛应用于铝的冶炼。工业上生产Na3AlF6的流程如下
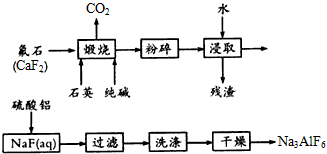
试结合生产流程回答下列问题
(1)煅烧时总反应的化学方程式为____________________。
(2)煅烧后的固体在浸取前进行粉碎的目的是____________,为达到相同目的,常温浸取时还可采取的措施是____________。
(3)97.5 kg含CaF2 80%氟石(杂质不含氟元素)理论上可生产Na3AlF6______kg(设生产过程中的每一步含氟物质均完全转化)。
(4)在按化学计量加入硫酸铝溶液前,需先用________将NaF(aq)的pH下调至5左右,否则可能产生的副产物为________。
(5)在铝的冶炼中,Na3AlF6是一种助熔剂,能使Al2O3在1000℃左右熔融,并可增强体系的导电性。下列有关Na3AlF6性质的叙述不正确的是________。
a.Na3AlF6在水中不存在沉淀溶解平衡
b.Na3AlF6是离子化合物
c.Na3AlF6热稳定性强
d.Na3AlF6是一种非电解质
参考答案:(1) CaF2+SiO2+Na2CO3=CaSiO3+2NaF+CO2↑
(2)加速可溶物的溶解;充分搅拌
(3)70
(4)硫酸;Al(OH)3
(5)ad
本题解析:
本题难度:一般