微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:

(1)溶解大理石时,用硝酸而不用硫酸的原因是_______________________________。
(2)操作Ⅱ的目的是______________,溶液A(溶质是共价化合物)是___________。
(3)写出检验滤液中是否含铁离子方程式:_____________________________________________。
(4)写出加入碳酸铵所发生反应的离子方程式:_______________________________,写出滤液B的一种用途:_________________________。
(5)CaO2中一般含CaO。试按下列提示完成CaO2含量分析的实验设计。试剂:氢氧化钠标准溶液、盐酸标准溶液、酚酞仪器:电子天平、锥形瓶、滴定管实验步骤:①_______;②加入_________;③加入酚酞,用氢氧化钠标准溶液滴定。
(6)若理论上滴定时耗用标准溶液20.00mL恰好完全反应,实际操作中过量半滴(1mL溶液为25滴),则相对误差为______________。
参考答案:(1)硫酸钙微溶于水
(2)除去溶液中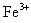 ;氨水
;氨水
(3)取少量滤液,向其中加入硫氰化钾溶液,溶液不变红色,说明滤液中不含 ; 或取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含
; 或取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含
(4) ;作化肥
;作化肥
(5)称量;过量的标准盐酸
(6)0.1%
本题解析:
本题难度:一般
2、选择题 下列物质的分离提纯的方法不正确的是
A.提纯工业酒精(含水、甲醇等)可用蒸馏的方法
B.提纯粗苯甲酸(含泥沙)用重结晶的方法
C.从碘水中提取碘,可用乙醇萃取的方法
D.分离饱和碳酸钠溶液和乙酸乙酯,可用分液的方法
参考答案:C
本题解析:乙醇和水互溶,不能作萃取碘水中的碘的萃取剂,应该选择苯或四氯化碳,C不正确,其余都是正确的,答案选C。
本题难度:简单
3、实验题 硫酸铜受热分解生成氧化铜和气体,加热温度不同,气体成分也不同。气体成分可能含SO2、SO3和O2中的一种、两种或三种。某化学课外活动小组通过设计探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验用到的仪器如下图所示:
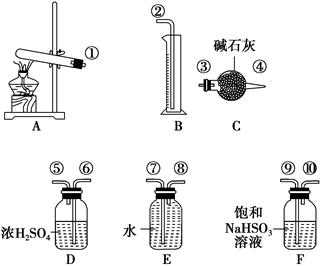
[提出猜想]
Ⅰ.所得气体的成分可能只含SO3一种;
Ⅱ.所得气体的成分可能含有________两种;
Ⅲ.所得气体的成分可能含有________三种。
[实验探究]
实验操作过程略。已知实验结束时,硫酸铜完全分解。
(1)请你组装探究实验的装置,按从左至右的方向,各仪器接口的连接顺序为①→⑨→⑩→⑥→⑤→________→________→________→________→②(填接口序号)。
(2)若实验结束时B中量筒没有收集到水,则证明猜想________正确。
(3)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后测得相关数据也不同,数据如下:
实验
小组
| 称取CuSO4
的质量/g
| 装置C增加
的质量/g
| 量筒中水的体积折算成标准状况下气体的体积/mL
|
一
| 6.4
| 2.56
| 448
|
二
| 6.4
| 2.56
| 224
|
?
请通过计算,推断出第一小组和第二小组的实验条件下CuSO4分解的化学方程式。
第一小组:________________________________________________________;
第二小组:________________________________________________________。
参考答案:Ⅱ.SO2、O2 Ⅲ.SO2、SO3、O2
(1)③ ④ ⑧ ⑦ (2)Ⅰ
(3)2CuSO4 2CuO+2SO2↑+O2↑? 4CuSO4
2CuO+2SO2↑+O2↑? 4CuSO4 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑
本题解析:本题考查硫酸铜分解产物的实验探究。氧化还原反应中化合价有升必有降,如果产物中只有两种气体,必为SO2、O2的混合物;如果有三种气体,则必为SO2、SO3、O2的混合物。(1)SO3溶于水生成硫酸,硫酸会与F中NaHSO3溶液反应生成SO2,通过浓硫酸干燥后,再通过碱石灰的增重情况可测定二氧化硫的质量,通过E、B装置所测气体的体积就是氧气的体积。(2)若B中量筒中没有收集到水,则说明实验中没有生成O2即猜想Ⅰ正确。(3)根据氧化还原反应中得失电子守恒,硫酸铜分解产生的SO2与O2的物质的量之比必为2∶1。实验中,如果产生的SO2与O2的物质的量之比不是2∶1,则说明分解产物中还含有SO3。第一小组:n(CuSO4)=0.04 mol,n(O2)=0.02 mol,n(SO2)=2.56 g÷64 g·mol-1=0.04 mol,SO2与O2的物质的量之比为2∶1,所以该小组硫酸铜分解的产物是CuO、SO2、O2。第二小组:n(CuSO4)=0.04 mol,n(O2)=0.01 mol,n(SO2)=0.04 mol,说明硫酸铜分解时还生成了0.02 mol SO3,据此即可写出反应的化学方程式。
本题难度:困难
4、选择题 下列实验操作中正确的是
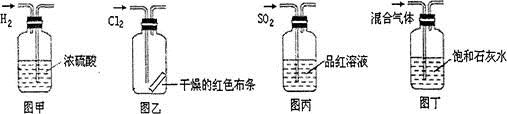
A.图甲所示,可得到干燥的氢气
B.图乙所示,可以验证氯气的漂白性
C.图丙所示,可以验证SO2的漂白性
D.图丁所示,若石灰水变浑浊,证明混合气体中一定含有CO2
参考答案:D
本题解析:A中不能得到干燥的氢气,因为进入管短,会把浓硫酸从长导管中压出,A错;布条是干燥的,无漂白性,B错;二氧化硫能使品红溶液褪色,证明二氧化硫的漂白性,C正确;能使澄清石灰水变浑浊不光是二氧化碳,也可能是二氧化硫,D错。答案选C。
本题难度:一般
5、选择题 同时除去混在CO2气体中的杂质HCl和SO2,应选择的试剂是
[? ]
A.苛性钠溶液
B.饱和碳酸氢钠溶液
C.饱和碳酸钠溶液
D.碱石灰
参考答案:B
本题解析:
本题难度:一般