|
高考化学知识点总结《醇》高频试题预测(2017年最新版)(六)
2017-03-03 00:09:39
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (15分)甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
⑴工业生产甲醇的常用方法是:CO(g)+2H2(g) CH3OH(g)?△H=-90.8 kJ/mol。 CH3OH(g)?△H=-90.8 kJ/mol。
已知:2H2(g)+ O2(g)= 2H2O (l)?△H=-571.6 kJ/mol
H2(g) + O2(g) = H2O(g)?△H=-241.8 kJ/mol O2(g) = H2O(g)?△H=-241.8 kJ/mol
①H2的燃烧热为?▲?kJ/mol。
②CH3OH(g)+O2(g) CO(g)+2H2O(g)的反应热△H=?▲?。 CO(g)+2H2O(g)的反应热△H=?▲?。
③若在恒温恒容的容器内进行反应CO(g)+2H2(g) CH3OH(g),则可用来判断该反应达到平衡状态的标志有?▲?。(填字母) CH3OH(g),则可用来判断该反应达到平衡状态的标志有?▲?。(填字母)
A.CO百分含量保持不变
B.容器中H2浓度与CO浓度相等
C.容器中混合气体的密度保持不变
D.CO的生成速率与CH3OH的生成速率相等
| ⑵工业上利用甲醇制备氢气的常用方法有两种:
①甲醇蒸汽重整法。该法中的一个主要反应为CH3OH(g) CO(g)+2H2(g),此反应能自发进行的原因是?▲?。 CO(g)+2H2(g),此反应能自发进行的原因是?▲?。
②甲醇部分氧化法。在一定温度下以Ag/CeO2—ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图所示。则当n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应方程式为?▲?;在制备H2时最好控制n(O2)/n(CH3OH)=?▲?。

⑶在稀硫酸介质中,甲醇燃料电池负极发生的电极反应式为?▲?。
参考答案:⑴①285.8?②-392.8 kJ/mol?③AD
⑵①该反应是一个熵增的反应 (△S>0)
②2CH3OH+O2 2HCHO+2H2O? 0.5 2HCHO+2H2O? 0.5
⑶CH3OH-6e-+H2O=CO2↑+6H+
(除第⑴③3分外,其余每空2分,共15分)
本题解析:(1)①燃烧热是指在25℃、101kPa下,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,所以由方程式2H2(g)+ O2(g)= 2H2O (l) △H=-571.6 kJ/mol 可得H2的燃烧热为285.8 kJ/mol;
②由方程式:CO(g)+2H2(g) CH3OH(g)?△H=-90.8 kJ/mol。 CH3OH(g)?△H=-90.8 kJ/mol。
2H2(g)+ O2(g)= 2H2O (l) △H=-571.6 kJ/mol
根据盖斯定律可得:CH3OH(g)+O2(g) CO(g)+2H2O(g) △H=-392.8 kJ/mol CO(g)+2H2O(g) △H=-392.8 kJ/mol
③判断该反应达到平衡状态的本质是:正反应速率=逆反应速率;混合物中各组分的浓度不变。所以A、D正确,容器中H2浓度与CO浓度相等不一定达到平衡,B错;C错,该反应是等体积反应,无论反应是否达到平衡密度始终保持不变,不一定是达到平衡状态。
⑵①CH3OH(g) CO(g)+2H2(g)的正反应方向为吸热反应,该反应能自发进行的原因是该反应是一个熵增的反应 (△S>0); CO(g)+2H2(g)的正反应方向为吸热反应,该反应能自发进行的原因是该反应是一个熵增的反应 (△S>0);
②当n(O2)/n(CH3OH)=0.25时,由图曲线分析可知主要是生成HCHO的反应,其反应的方程式为:2CH3OH+O2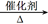 2HCHO+2H2O;在制备H2时最好控制n(O2)/n(CH3OH)=0.5 2HCHO+2H2O;在制备H2时最好控制n(O2)/n(CH3OH)=0.5
(3)关于燃料电池的电极反应方程式的写法原则:首先写燃料电池的总反应方程式,其反应的总反应方程式与燃料直接燃烧的方程式相同;第二步,再写正极电极反应,因为正极均为氧气得电子,在酸性溶液中其电极反应式为:O2+4e-+4H+=2H2O;第三步,将总反应方程式减去正极反应式得到负极电极反应式。
本题难度:简单
2、选择题 酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色的Cr3+。下列对乙醇性质的描述与此测定原理有关的是
[? ]
①乙醇沸点低
②乙醇密度比水小
③乙醇有还原性
④乙醇是烃的含氧化合物
A.②④
B.②③
C.①③
D.①④
参考答案:C
本题解析:
本题难度:一般
3、选择题 向盛有乙醇的烧杯中投入一小块金属钠,可以观察到的现象是( )
A.钠块沉在乙醇液面下面
B.钠块熔成小球
C.钠块在乙醇液面上游动
D.钠块表面有气泡生成
参考答案:AD
本题解析:
本题难度:简单
4、填空题 得到乙醇至少有四种方法,请用化学方程式表示:
(1)发生______反应:________________________
(2)发生______反应:________________________
(3)发生______反应:________________________
(4)发生______反应:________________________
参考答案:(1)加成;
(2)取代;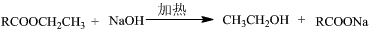
(3)取代;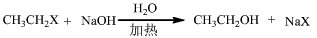
(4)加成(或还原);
本题解析:
本题难度:一般
5、简答题 甲、乙、丙三人分别将乙酸与乙醇反应得到的酯提纯.在未用指示剂的情况下,他们都是先加入NaOH溶液中和过量的酸,然后用蒸馏法将酯分离出来.但他们的结果却不同:
①甲得到了不溶于水的中性酯②乙得到显酸性的酯的混合物③丙得到大量水溶性物质,试分析产生上述各种结果的原因.
①______;②______;③______.
参考答案:①甲得到了不溶于水的中性酯,没有酸,说明所加NaOH溶液恰好中和了过量的酸,故答案为:所加NaOH溶液恰好中和了过量的酸;
②乙得到显酸性的酯的混合物,酸有剩余,说明是所加NaOH溶液不足未将酸完全反应,故答案为:所加NaOH溶液不足未将酸完全反应;
③丙得到大量水溶性物质,说明没有酯,是因为所加NaOH溶液过量,酯发生水解,故答案为:所加NaOH溶液过量,酯发生水解.
本题解析:
本题难度:一般
|  CO(g)+2H2(g),此反应能自发进行的原因是?▲?。
CO(g)+2H2(g),此反应能自发进行的原因是?▲?。 