微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 Na2O2曾经是潜水艇或航天器中最理想的供氧剂。下表是人体呼出气体的成分(均为体积百分含最)。
?
| 空气
成分
| 人体呼出
气体成分
|
N2
| 78%
| ? 74%
|
O2
| 21%
| ? 16%
|
H2O
| 0. 5%
| ? 6%
|
CO2
| 0. 03%
| ? 4%
|
?
(1)已知一个人一天大约要产生16 mol CO2。若全部被Na2O2吸收,需要Na2O2________ g。
(2)若要使被吸收的CO2与产生的O2体积相等,就需
要在Na2O2中添加KO2.计算要达到该目的.Na2O2与KO2的物质的量比例是?。
已知:4KO2+2CO2=2K2CO3+3O2
(3)计算100 L空气经过人体呼吸后,呼出气体中O2的体积(标准状况下,保留2位小数)____?L。
(4)为保持航天器中空气成分恒定,并充分利用资源,需对人体呼出的气体进行处 理,无用物质排出航天器。100 L空气经过人体呼吸后,欲使呼出的气体经过处理后恢复原空气成分且体积仍为100 L(可供使用的化学试剂只有Na2O2).通过计算回答:若先利用CO2,还需要利用水蒸气,求需要水蒸气体积?L。
参考答案:(1)1248?
(2)n(Na2O2):n(KO2)=1:2?(3)V(O2)=16.86L
(4)4.10
本题解析:
(1)过氧化钠和二氧化碳的反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,设需要过氧化钠的质量为x,
2Na2O2+2CO2=2Na2CO3+O2
156g? 2mol
x? 16mol
x=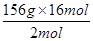 =1248g
=1248g
(2)Na2O2和 CO2反应方程式为:2Na2O2+2CO2=2Na2CO3+O2, KO2和 CO2反应方程式为:4KO2+2CO2=2K2CO3+3O2,根据反应方程式知,要使被吸收的CO2与产生的O2体积相等,则参加反应的n(Na2O2):n(KO2)=2:4=1:2
(3)呼吸前后,氮气不参加反应,所以氮气的量不变,呼入的气体中氮气体积=100L×78%=78L,氮气的量不变,所以呼出的气体体积=78L÷74%=105.4L,所以V(O2)=78L/74%×16%=16.86L。
(4)呼入气体中氧气的体积=100L×21%=21L,呼出的气体中氧气的体积是16.86L,所以氧气体积减少为(21-16.86)L=4.14L?O2。
二氧化碳气体增加的量=78L/74%×4%-100L×0.03%=4.22L-0.03L=4.19L,将增加的CO2用Na2O2吸收,生成O2是二氧化碳的一半为2.095L,为补足减少的4.14L?O2,还需要2.045L?O2,则需要用Na2O2吸收 H2O体积为氧气的2倍=2.045L×2=4.09L,剩余的水=6.32L-4.09L=1.73L液化回收。还需要水蒸气参加反应,需要水蒸气的体积是4.10L
本题难度:一般
2、计算题 (10分)取100mL的Na2CO3和Na2SO4混合溶液,加入足量Ba(OH)?2溶液,恰好完全反应,过滤、干燥后得到24.36g白色沉淀,再用过量稀硝酸处理沉淀,最后减少到4.66g,并有气体放出。计算:(请写出计算过程)?
(1)原混合液中Na2SO4的物质的量浓度为?
(2)产生的气体在标准状况下的体积为?
参考答案:(1)0.2molL-1
(2)2.24L
本题解析:略
本题难度:一般
3、选择题 只给出下列甲中和乙中对应的量,不能组成一个求物质的量的公式的是

[? ]
A.③
B.③④
C.②③④
D.③④⑤
参考答案:B
本题解析:
本题难度:简单
4、简答题 配制480mL1mol/LNaOH溶液时:
(1)需要______mL的容量瓶.
(2)下列哪些操作会使实验结果偏高______,偏低______,无影响______.
A.振荡,摇匀溶液后,发现液面低于刻度线,再补加水
B.称量时,固体放在右盘,砝码放在左盘(未用游码)
C.原容量瓶洗涤后未干燥D.定容时俯视刻度线
E.移液时,未洗涤烧杯和玻璃棒
F.在烧杯中溶解NaOH固体后,未冷却立即将溶液注入容量瓶中.
参考答案:解(1)配制480mL溶液,需要选用500mL容量瓶,故答案为:500;
(2)A.再补加水,导致加入的蒸馏水体积偏大,配制的溶液浓度偏低;
B.称量NaOH时,砝码错放在左盘(未用游码),称量的氢氧化钠质量不变,配制的溶液的浓度不变;
C.配制前,容量瓶中有少量蒸馏水,对溶质的物质的量及最终溶液体积没有影响,所以不影响配制结果;
D.定容时俯视刻度线,导致加入的蒸馏水体积偏小,配制的溶液浓度偏高;
E.移液时,未洗涤烧杯和玻璃棒,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏小;
F.未冷却,由于热胀冷缩,导致所配溶液体积偏小,故所配溶液浓度偏大;
故答案为:D、F;A、E;B、C.
本题解析:
本题难度:一般
5、选择题 用NA表示阿伏加德罗常数,下列说法正确的是
A.78g Na2O2与足量水反应中电子转移了2NA
B.只有在标准状况下NA个氧气分子的物质的量才是1mol
C.常温常压下,22.4L N2气体的分子数小于NA
D.20g D2O所含的中子数为9NA
参考答案:C
本题解析:A 错误,78g Na2O2与足量水反应中电子转移了NA
B 错误,不是标准状况,NA个氧气分子的物质的量也可能是1mol
C 正确。标况下,22.4L N2气体的分子数等于NA,而常温常压,温度比标况下的温度高了,显然,22.4L N2气体的分子数小于NA
D 错误,20g D2O所含的中子数为10NA
本题难度:一般