微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组混合物中,用分液漏斗不能分离的是( )
A.正己烷和水
B.甲苯和水
C.乙酸和乙醇
D.溴苯和水
参考答案:A.正己烷和水互不相溶,能用分液漏斗分离,故A不选;
B.甲苯和水互不相溶,能用分液漏斗分离,故B不选;
C.乙酸和乙醇混合后不分层,用分液漏斗不能分离,故C选;
D.溴苯和水互不相溶,能用分液漏斗分离,故D不选;
故选C.
本题解析:
本题难度:简单
2、选择题 为提纯下列物质(括号内为杂质),选用的除杂试剂和分离方法都正确的是
?
| 物质
| 除杂试剂
| 分离方法
|
A
| 二氧化硅(碳酸钙)
| 氢氧化钠
| 重结晶
|
B
| 硫酸铜溶液(硫酸铁)
| 加入过量铜粉
| 过滤
|
C
| 乙醇(乙酸)
| 生石灰
| 蒸馏
|
D
| 苯(苯酚)
| 浓溴水
| 分液
|
?
参考答案:
C
本题解析:
除杂的原则:杂转纯、杂变沉、化为气、溶剂分。注意:不能带人新的杂质。
A中二氧化硅与氢氧化钠发生化学反应,B中带人Fe2+?,D中的苯溶有溴杂质
本题难度:一般
3、选择题 1 mol·L-1的NaCl溶液表示
A.溶液中含有1 molNaCl
B.1 molNaCl溶于1 L水中
C.58.5 gNaCl溶于941.5 g水中
D.1 L溶液里有NaCl58.5 g
参考答案:D
本题解析:物质的量浓度是指单位体积(单位:L)的溶液中所含溶质的物质的量(一般用mol作单位).注意其中体积为溶液的体积,不是溶剂的体积,也不是溶剂的体积加溶质的体积.
本题难度:一般
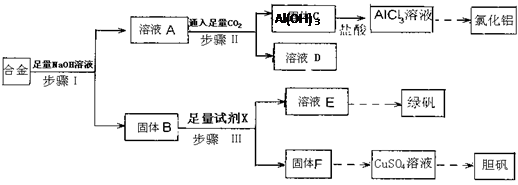
4、填空题 (12分)为探索工业废料的再利用,某化学兴趣小组设计了如下图所示实验方案,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
 ?
?
请回答:
(1)步骤I、II、III中均需进行的实验操作是?。
(2)溶液D中的离子主要有?;试剂X是?。
(3)进行步骤II时,该小组用右图装置及试剂将制得的CO2通入溶液A中,一段时间后,观察到烧杯中产生的Al(OH)3沉淀逐渐减少,其原因是?(用离子方程式表示);为了避免Al(OH)3沉淀减少,根据右图所示,改进的措施是?。
(4)从氧化还原反应和环保角度考虑,用F制备CuSO4时需要氧气和硫酸共同参与,对应的化学方程式是?。
参考答案:(12分)(1)过滤?(2) ;?稀硫酸
;?稀硫酸
(3)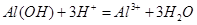 ; 在装置I、II之间增加一个盛有饱和
; 在装置I、II之间增加一个盛有饱和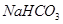 溶液的洗气瓶
溶液的洗气瓶
(4)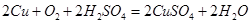
本题解析:合金中只有铝可溶与NaOH溶液:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,经过滤得到固体B:铁与铜,而溶液A为NaAlO2及过量的NaOH混合溶液;
往溶液A中通入足量的CO2气体:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;NaOH+CO2=NaHCO3,过滤后滤液D的成分主要为NaHCO3溶液;
固体B(铁与铜)最终均要转化为硫酸盐,故试剂X为稀硫酸:Fe+H2SO4=FeSO4+H2↑,过滤后得到固体F:铜
(1)步骤I、II、III均是将不溶物与液体分离,为过滤操作
(2)滤液D为NaHCO3溶液,所含离子为: ,试剂X是稀硫酸
,试剂X是稀硫酸
(3)浓盐酸易挥发,制取的CO2气体中混有HCl,故: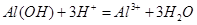 ;为了除去CO2气体中混有HCl,最好用碳酸的酸式盐,例如NaHCO3溶液:在装置I、II之间增加一个盛有饱和
;为了除去CO2气体中混有HCl,最好用碳酸的酸式盐,例如NaHCO3溶液:在装置I、II之间增加一个盛有饱和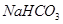 溶液的洗气瓶
溶液的洗气瓶
(4)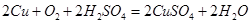
本题难度:一般
5、选择题 下列实验操作正确的是
[? ]
A.用饱和溴水除去甲苯中混有的苯酚
B.用氨水洗涤除去试管内壁上的银镜
C.实验室用加热NH4Cl固体使之分解的方法制NH3
D.用稀硫酸和Zn反应制H2时,加少量的CuSO4溶液可加快反应速率
参考答案:D
本题解析:
本题难度:一般