微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 氯只有35Cl和37Cl两各稳定同位素,它们在氯气中的原子数之比35Cl:37Cl 为3:1。则分子量为70、72、74的氯气分子数之比可能是
[? ]
A.5:2:1
B.5:2:2
C.9:3:1
D.9:3:2
参考答案:AD
本题解析:
本题难度:一般
2、选择题 元素周期表和元素周期律对生产生活有一定的指导意义.小明想从元素周期表中寻找半导体材料,你认为他应该在周期表的哪个区域寻找( )
A.过渡元素区
B.稀有气体元素区
C.镧系、锕系区
D.金属元素与非金属元素交界处附近
参考答案:在过渡元素区中寻找催化剂、耐高温、耐腐蚀的合金材料,金属元素与非金属元素交界处的元素,既可表现一定的金属性又能表现一定的非金属性,故在金属元素与非金属元素交界处附近,可以找到半导体材料,故选D.
本题解析:
本题难度:简单
3、选择题 下列比较正确的是
A.原子半径: Cl > S
B.碱性:Mg(OH)2>Ca(OH)2
C.稳定性:PH3 > AsH3
D.沸点:HCl>HF
参考答案:C
本题解析:
本题难度:困难
4、简答题 下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
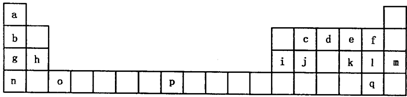
试回答下列问题:
(1)请写出元素o的基态原子电子排布式______,g元素的价电子的四个量子数依次是______.
(2)d的氢化物中心原子的杂化方式是______.
(3)o元素所在族的符号是______.
(4)d的氢化物与l的氢化物反应后的产物中包含的化学键是______.
(5)f、l、q的氢化物中沸点最高的是______.(写化学式)
(6)j原子形成的晶体与j原子跟c原子以1:1相互交替结合而形成的jc晶体类型相同.则j晶体的熔点______jc晶体的熔点(填“大于”“等于”“小于”)原因是______.
参考答案:(1)o为Sc元素,原子序数为21,基态原子的电子排布式为1s22s22p63s23p63d14s2,g为Na元素,价层电子为3s1,
其中n=3,l=0,m=0,ms=+12(或-12),
故答案为:1s22s22p63s23p63d14s2;3,0,0,+12(或-12);
(2)d为N元素,氢化物为NH3,分子中含有3个δ键,一个孤电子对,所以为sp3杂化,故答案为:sp3;
(3)o为Sc元素,原子序数为21,位于第三周期ⅢB族,故答案为:ⅢB;
(4)d为N元素,l为Cl元素,二者氢化物反应后的产物为NH4Cl,为含有共价键的离子化合物,并且含有配位键,
故答案为:离子键,共价键,配位键;
(5)f为F元素,HF中中含有氢键,沸点最高,故答案为:HF;
(6)j原子形成的晶体为Si晶体,j原子跟c原子以1:1相互交替结合而形成的jc晶体为SiC,都是原子晶体,SiC中C-Si键的键长比晶体Si中Si-Si键长短,所以其键能大,因而熔沸点高,
故答案为:小于;因SiC晶体与晶体Si都是原子晶体,SiC中C-Si键的键长比晶体Si中Si-Si键长短,所以其键能大,因而熔沸点高.
本题解析:
本题难度:一般
5、填空题 填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:_______________;
(2)周期表中最活泼的非金属元素位于第____________族;
(3)所含元素种类是8种的周期是第_________、_________周期。
(4)氯元素在周期表中位于第______周期第______族。氯的最高价氧化物的化学式为__________,最高价氧化物的水化物的化学式为__________。
(5)物质在下列变化过程中克服的是:①共价键 ②离子键。(填序号)
HCl溶于水__________
电解熔融NaCl制Na__________
电解水分解生成O2和H2__________
(6)在下述反应中,属于取代反应的是_____;属于氧化反应的是_____;属于加成反应的是______。
①乙烯使溴水褪色 ②乙烯使酸性高锰酸钾溶液褪色③苯与浓硝酸制硝基
参考答案:(1)188O
(2)ⅦA
(3)二;三
(4)三;ⅦA;Cl2O7;HClO4
(5)①;②;①
(6)③;②;①
本题解析:
本题难度:一般