微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组离子一定能大量共存的是
A.常温下 的溶液:
的溶液: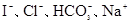
B.含有大量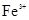 的溶液:
的溶液: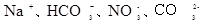

C.加入铝粉能产生氢气的溶液: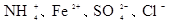
D.由水电离出的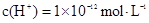 溶液:
溶液: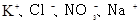
参考答案:D
本题解析:A错,常温下 的溶液为碱性溶液,在碱性溶液中
的溶液为碱性溶液,在碱性溶液中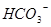 I不能共存;B错,
I不能共存;B错,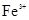 与碳酸根离子不能共存会发生双水解反应;C错,加入铝粉能产生氢气的溶液可以是酸溶液,也可以是碱溶液,铵离子、亚铁离子在碱溶液中不能共存;D正确;
与碳酸根离子不能共存会发生双水解反应;C错,加入铝粉能产生氢气的溶液可以是酸溶液,也可以是碱溶液,铵离子、亚铁离子在碱溶液中不能共存;D正确;
本题难度:一般
2、填空题 下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃)。
电解质
| 电离方程式
| 电离常数K
| Ksp
|
H2CO3
| H2CO3 HCO3-+H+ HCO3-+H+
HCO3- CO32-+H+ CO32-+H+
| K1=4.31×10-7
K2=5.61×10-11
| -
|
C6H5OH
| C6H5OH C6H5O-+H+ C6H5O-+H+
| 1.1×10-10
| -
|
H3PO4
| H3PO4 H2PO4-+H+ H2PO4-+H+
H2PO4- HPO42-+H+ HPO42-+H+
HPO42- PO43-+H+ PO43-+H+
| K1=7.52×10-3
K2=6.23×10-6
K1=2.20×10-13
| -
|
NH3·H2O
| NH3·H2O OH-+NH4+ OH-+NH4+
| 1.76×10-5
| -
|
BaSO4
| BaSO4(s) Ba2++SO42- Ba2++SO42-
| -
| 1.07×10-10
|
回答下列问题:
(1)写出C6H5OH与Na3PO4反应的离子方程式:_________________。
(2)25℃时,向10 mL 0. 01 mol/LC6H5OH溶液中滴加V mL 0.1 mol/L氨水,混合溶液中粒子浓度关系正确的是__________(填序号)。
a.若混合液pH>7,则V≥10
b.V=5时,2c(NH3·H2O)+2c(NH4+)=c(C6H5OH)+c(C6H5O-)
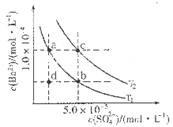
c.V=10时,混合液中水的电离程度小于0.01 mol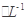 C6H5OH溶液中水的电离程度
C6H5OH溶液中水的电离程度
d.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
(3)水解反应的化学平衡常数称为水解常数(用Kb表示),类比化学平衡常数的定义。25℃时,Na2CO3第一步水解反应的水解常数Kb=____mol/L。
(4)如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线(已知BaSO4的Ksp随温度升高而增大)。
①T2____ 25℃(填“>”、“<”或“=”);
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是____(填序号)。
a.加入Na2SO4不能使溶液由a点变为b点
b.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
c.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
d.升温可使溶液由b点变为d点
参考答案:(1)C6H5OH+PO33-=C6H5O-+HPO42-(2分) (2)b(2分) (3)1.78×10-4(2分)
(4)①>(2分) ②bc(全对得2分,只选一个且正确得1分,多选或错选的0分)
本题解析:
试题分析:(1)弱酸的电离常数越大,酸性越强。根据电离平衡常数可知,苯酚的电离常数小于磷酸的第一步和第二步电离平衡常数,而大于磷酸的第三部电离平衡常数,所以依据较强酸制备较弱酸的原理可知C6H5OH与Na3PO4反应的离子方程式为C6H5OH+PO33-=C6H5O-+HPO42-。
(2)氨水的电离平衡常数大于苯酚的电离常数,所以C6H5O-的水解程度大于NH4+的水解程度。V=10时,二者恰好反应生成苯酚铵。由于C6H5O-的水解程度大于NH4+的水解程度,因此溶液显碱性。a、若混合液pH>7,则V不一定等于等于≥10,a不正确;b、V=5时,苯酚过量,所得溶液是苯酚铵和苯酚的混合液,且二者的浓度相等。所以根据物料守恒可知2c(NH3·H2O)+2c(NH4+)=c(C6H5OH)+c(C6H5O-),b正确;c、V=10时,二者恰好反应生成苯酚铵。由于C6H5O-的水解程度大于NH4+的水解程度,因此溶液显碱性。苯酚能电离出氢离子,抑制水的电离,所以混合液中水的电离程度大于0.01mol/LC6H5OH溶液中水的电离程度,c正确;d、若混合液pH<7,则苯酚一定是过量的,所以溶液中离子浓度大小顺序是c(C6H5O-)>c(NH4+)>c(H+)>c(OH-)或c(C6H5O-)>c(H+)>c(NH4+)>c(OH-),d不正确,答案选b。
(3)水解反应的化学平衡常数称为水解常数(用Kb表示),类比化学平衡常数的定义。25℃时,Na2CO3第一步水解反应的水解常数Kb=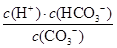 =
=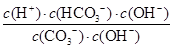 =
=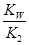 =
=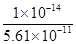 =1.78×10-4。
=1.78×10-4。
(4)①根据图像可知c点表示平衡点,此时溶度积常数=1.0×10-4×5.0×10-5=5.0×10-9>1.07×10-10。由于BaSO4的Ksp随温度升高而增大,所以温度T2>25℃。
②a.加入Na2SO4增大溶液中的SO42-浓度,可以使不溶液由a点变为b点,a不正确;b.在T1曲线上方区域(不含曲线)任意一点时,溶液中c(Ba2+)·c(SO42-)均大于T1温度下的溶度积常数,所以有BaSO4沉淀生成,b正确;c.d在曲线的下方,蒸发溶剂溶液中c(Ba2+)、c(SO42-)均增大,因此可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b),c不正确;d.BaSO4的Ksp随温度升高而增大,所以升温不可能使溶液由b点变为d点,d不正确,bc。
本题难度:困难
3、选择题 常温下,下列各组离子在指定溶液中一定能大量共存的是(?)
A.1.0mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
C.pH=12的溶液:K+、Na+、CH3COO-、Br-
D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3-
参考答案:C
本题解析:A:硝酸根离子能把二价铁离子氧化成三价铁离子,不能共存;B:甲基橙的变色范围是pH<3.1的变红,pH>4.4的变黄,3.1-~4.4的呈橙色,使甲基橙变红的是酸性溶液,含有H+,会和AlO2-反应生成Al(OH)3沉淀B错;D:能与铝反应产生大量氢气的是强酸或强碱溶液,若是强酸溶液CO32-不能大量存在,故选C
点评:离子共存注意条件中的隐含意思
本题难度:简单
4、选择题 下列各组离子能大量共存,向溶液中通入足量相应气体后,各离子还能大量存在的是
A.氯气:K+、Ba2+、SiO32-、NO3-
B.二氧化硫:Na+、NH4+、SO32-、C1-
C.氨气:K+、Na+、AlO2-、CO32-
D.甲醛:Ca2+、Mg2+、MnO4-、NO3-
参考答案:C
本题解析:A.离子会发生反应:Ba2+ +SiO32-= BaSiO3↓,不能大量共存。错误。B.若通入SO2,会发生反应:SO2+H2O+ SO32-=2HSO3-。不能大量共存。错误。C.离子无论是否通入氨气,都不会发生任何反应。可以大量共存。正确。D. 甲醛有还原性,而MnO4-有强氧化性,二者会发生氧化还原反应而不能大量共存。错误。
本题难度:一般
5、选择题 下列各组离子一定能大量共存的是
[? ]
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
B.在含有Al3+、Cl-的溶液中:HCO3-、I-、NH4+、Mg2+
C.在c(H+)=1×10-13 mol·L-1的溶液中:Na+、S2-、SO32- 、NO3-
D.在溶质为KNO3和NaHSO4的溶液中:Fe2+、Ca2+、Al3+、Cl-
参考答案:C
本题解析:
本题难度:一般