微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 铝可以从铝土矿中获取,铝土矿是不纯净的铝的氧化物(杂质为Fe2O3和SiO2),它是非再生资源。假如我们对铝的消费保持现有速度,我们能获得生产足够的铝所需的铝土矿仅能维持30年左右。由此看来,保护现有自然资源和对非再生资源的再利用,是值得我们考虑的。但是在废物回收过程中,仍有相当大的难度,其关键的因素主要涉及旧金属的收集与其他废物的分离、回收和提炼金属的费用、金属本身的价值等(已知1?mol电子电量荷约为105?C)。
(1)试说明回收铝的过程中存在的困难。_____________________
(2)为什么金的回收率比铝的回收率要大得多?_________________
(3)常温下,SiO2同强碱或强酸是很难反应的,现利用盐酸、氢氧化钠溶液、氮气、二氧化碳和水,从铝土矿中提取纯净的Al2O3。试设计一个适用于工业生产上提纯Al2O3的实验方案,用化学方程式表示提纯的过程。_____________________
(4)制取1?mol?Al理论上需要多少库仑的电荷量?___________________
(5)假定用6?V的直流电源进行电解,制2.7吨铝需要多少千焦的电能?(请列式并计算)
(6)在1.01×105?Pa,27?℃时,每生产1?mol?Al,理论上在阳极生成O2的体积为多少升?(请列式并计算)
(7)如果每度电的费用为0.60元,试计算生产厂家每生产1吨铝需付出的电费为多少元。(1度电=3?600?kJ)(请列式计算)
参考答案:(1)回收铝的过程中存在的困难是:①人们的环境意识薄弱;②回收和提炼金属的费用较高;③铝同其他废物的分离较困难;④铝本身价值并不高;⑤旧金属的收集缺乏专门的机构
(2)金比铝价值要高,另一方面,金活动性弱,容易回收
(3)Fe2O3和SiO2与强碱都不反应,因此可把铝土矿溶于强碱溶液中,过滤除去杂质,即得到偏铝酸钠溶液,往滤液中加酸即可得氢氧化铝沉淀,由于氢氧化铝沉淀可和强酸反应,所以要得到较多的沉淀,最好加弱酸,方程式表示为:
①Al2O3+2NaOH====2NaAlO2+H2O
②NaAlO2+CO2+2H2O====Al(OH)3↓+NaHCO3
③2Al(OH)3====Al2O3+3H2O
(4)这是一个涉及氧化还原反应的问题。氧化铝要被还原成单质铝,化合价必须从+3降低到0,即要得到1?mol?Al必须转移3?mol的电子,所需电荷量为3×105C。
(5)直接代入物理中有关电能的计算公式,可得:2.7×106/27×3×105×6×10-3kJ=1.8×108kJ
(6)根据电解方程:2Al2O3====4Al+3O2↑,每产生1?mol?Al的同时生成0.75?mol?O2,由于此状态是非标准状态,要求氧气的体积还要进行体积的转化。300×0.75×22.4/273=18.5L
(7)1×106/27×3×105×6×10-3/3600×0.6=1.1×104
本题解析:
本题难度:一般
2、计算题 维生素C(又名抗坏血酸,分子式为C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可通过在弱酸性溶液中用已知溶液的I2溶液进行滴定。该反应的化学方程式如下:C6H8O6+I2==C6H6O6+2HI 现欲测定某样品中维生素C的含量,具体的步骤及测得的数据如下。取10mL 6mol·L-1CH3COOH,加入100mL蒸馏水,将溶液加热煮沸后放置冷却。精确称取0.2000g样品,溶解于上述冷却的溶液中,加入1mL淀粉指示剂,立即用浓度为0.05000mol·L-1的I2溶液进行滴定,直至溶液中的蓝色持续不褪为止,共消耗
21.00mLI2溶液。
(1)为何加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用?___________________
(2)计算样品中维生素C的质量分数。
参考答案:(1)煮沸是为了除去溶液中溶液的O2,避免维生素C被O2氧化,冷却是为了减缓滴定过程中维生素C与液面上空气接触时被氧化的速度。 (2)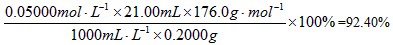
本题解析:
本题难度:一般
3、填空题 实验室制取Cl2的反应为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,若制得标准状况下的Cl24.48L,则被氧化的HCl的物质的量为______mol,转移电子的物质的量为______mol.
参考答案:标准状况下的Cl24.48L,n(Cl2)=4.48L22.4L/mol=0.2mol,
反应中Cl元素的化合价升高被氧化,则被氧化的HCl的物质的量为2×n(Cl2)=0.4mol,
转移的电子为0.2mol×2×[0-(-1)]=0.4mol,
故答案为:0.4;0.4.
本题解析:
本题难度:一般
4、填空题 随着材料科学的发展,金属钒及其化合物得到了广泛的应用,并被称为“合金维生素”。已知钒的原子序数为23,回答下列问题:
(1)钾钒铀矿的化学式为K2H6U2V2O15,其中钒离子的最外层为8电子稳定结构,若用氧化物的形式表示,钾钒铀矿的化学式为________________________;
(2)测定钒的含量的方法是先把钒转化为V2O5,V2O5在酸性溶液中转变成VO2+,再用盐酸、硫酸亚铁、草酸等测定钒。请配平下列化学方程式并标出电子转移的方向和数目:
①____VO2+ + ____H2C2O4 = ____VO+ + ____ CO2 + ____H2O
②其中还原剂是________,若消耗0.9g草酸,所对应钒元素质量是____________g。
参考答案:(1)K2O·V2O5·2UO3·3H2O
(2)①1、1、1、2、1;②H2C2O4;0.51
本题解析:
本题难度:一般
5、选择题 1966年,范克(Fwnk.J.E)等人提出热化学循环制氢法:
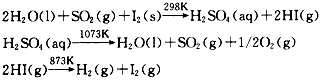
从理论上讲,该循环中1mol H2O能制氢气
[? ]
A.0. 25 mol
B.0.5 mol
C.1 mol
D.2 mol
参考答案:C
本题解析:
本题难度:简单