微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在同温同压下将SO2和Cl2按1:1体积比混合后,通入BaCl2和品红的混合溶液中,下列说法正确的是( )
A.溶液褪色,无沉淀生成
B.溶液不褪色,无沉淀生成
C.溶液褪色,有沉淀生成
D.溶液不褪色,有沉淀生成
参考答案:SO2和Cl2按1:1体积比混合后,通入BaCl2和品红的混合溶液中发生反应:SO2+Cl2+2H2O=H2SO4+2HCl;
A、溶液不褪色,有白色硫酸钡沉淀生成,故A错误;
B、溶液不褪色,有白色硫酸钡沉淀生成,故B错误;
C、溶液不褪色,有白色硫酸钡沉淀生成,故C错误;
D、溶液不褪色,有白色硫酸钡沉淀生成,故D正确;
故选D.
本题解析:
本题难度:简单
2、简答题 (14分)
研究小组用下图装置制取Cl2,证明产生的气体中含有HCl。

(1)仪器A的名称为?;A中反应的离子方程式为?。
(2)甲同学将A中产生的气体通入下列溶液:
实验序号
| 试剂
| 现象
|
a
| 紫色石蕊溶液
| ??
|
b
| AgNO3溶液
| 出现白色沉淀
|
①实验a中的现象为?。
②不能证明产生的气体中含有HCl的实验是?(填字母序号)。
(3)已知将HCl气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因:?。
(4)已知:2S2O32- + I2 ="==" S4O62- + 2I-。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl。
I.测定X中溶解的Cl2。取25.00 mL溶液X,加入过量KI溶液,然后用0.04 mol?L-1 Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3溶液V mL。
II.测定X中Cl元素总量。另取25.00 mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl-,再用0.10 mol?L-1 AgNO3溶液滴定所得溶液中的Cl-。
X中的HClO不会影响I的测定结果,原因是?。
由I、II 中实验数据可证明A中产生的气体中含有HCl,则II中消耗0.10 mol?L-1 AgNO3溶液的体积应大于?mL(用含V的代数式表示)。
参考答案:(14分)
(1)圆底烧瓶(1分)? 4H++2Cl-+MnO2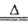 2H2O + Cl2↑+Mn2+
2H2O + Cl2↑+Mn2+
(2)①溶液先变红再褪色 ②a、b
(3)Cl2+ H2O HCl+HClO,Cl2溶于水后使得溶液中的c(Cl-)增大,也能析出晶体。
HCl+HClO,Cl2溶于水后使得溶液中的c(Cl-)增大,也能析出晶体。
(4)(3分)
①答案一:生成1 mol HClO需消耗1 mol Cl2(1分), HClO也有氧化性,1 mol HClO和1 mol Cl2均能将2 mol KI氧化成I2(2分)。
答案二: Cl2+ H2O HCl+HClO,Cl2发生反应时,上述平衡逆向移动,相当于Cl2全部参与氧化I-的反应。
HCl+HClO,Cl2发生反应时,上述平衡逆向移动,相当于Cl2全部参与氧化I-的反应。
②0.4V
本题解析:(1)仪器A的名称为圆底烧瓶;A是二氧化锰与浓盐酸制取氯气的反应,离子方程式为4H++2Cl-+MnO2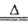 2H2O + Cl2↑+Mn2+
2H2O + Cl2↑+Mn2+
(2)①氯气溶于水生成氯化氢和次氯酸,溶液呈酸性,所以石蕊试液变红;次氯酸具有漂白性,随后溶液红色褪去;
②ab都不能证明产生的气体中含有HCl。因为氯气溶于水生成氯化氢,所以即使产生的气体中不含氯化氢,石蕊试液也会变红;同时生成的氯化氢与硝酸银溶液反应生成氯化银沉淀,不能说明产生的气体中有氯化氢;
(3)氯气与水反应生成氯化氢和次氯酸,Cl2+ H2O HCl+HClO,Cl2溶于水后使得溶液中的c(Cl-)增大,也能析出晶体。
HCl+HClO,Cl2溶于水后使得溶液中的c(Cl-)增大,也能析出晶体。
(4)①生成1 mol HClO需消耗1 mol Cl2, HClO也有氧化性,1 mol HClO和1 mol Cl2均能将2 mol KI氧化成I2,所以HClO的存在不影响实验结果;或者Cl2+ H2O HCl+HClO,Cl2氧化KI时,上述平衡逆向移动,相当于Cl2全部参与氧化I-的反应。
HCl+HClO,Cl2氧化KI时,上述平衡逆向移动,相当于Cl2全部参与氧化I-的反应。
②I中测定Cl2的物质的量是0.04 mol?L-1×V×10-3L×1/2,则转化为Cl-的物质的量是0.04V×10-3mol;不考虑气体中的氯化氢,氯气转化的Cl-需要硝酸银的体积是0.04V×10-3mol/0.1mol/L=0.4VmL,所以II中消耗0.10 mol?L-1 AgNO3溶液的体积应大于0.4VmL,说明气体中含有HCl。
本题难度:一般
3、填空题 (10分)新制氯水中含有Cl2、H2O、HClO、H+、Cl-等粒子,根据下列性质选择恰当的粒子进行填空。
(1)使新制氯水呈现浅黄绿色的物质是?;
(2)能起杀菌消毒作用,光照易分解的弱酸是?;
(3)能与硝酸银溶液作用生成白色沉淀的离子是?。
(4)取少量新制氯水于试管中,加入FeCl2溶液,发现很快变黄,起作用的成分是Cl2,说明氯气具有?性。写出该反应的离子方程式?。
参考答案:(1)Cl2(2)HClO?(3)Cl- ?(4)氧化?2Fe2++Cl2 =2Fe3++2Cl-
本题解析:(1)氯气为黄绿色气体,在水中溶解度较小,从而使新制氯水呈现浅黄绿色;
(4)2FeCl2+Cl2=2FeCl3,Cl2中氯的化合价由0价降低到-1价,被还原,做氧化剂;
本题难度:一般
4、选择题 长期以来一直认为氟的含氧酸不存在,自1971年美国科学家用F2通过细冰来获得次氟酸(HFO)以来,对HFO的研究引起了充分重视。
(1)次氟酸能与水反应得到溶液A,A中含B、C两种溶质,B常用于雕刻玻璃,C在加热条件下分解生成一种能使带火星的木条复燃的气体(已知2H2O2 2H2O+O2↑),则次氟酸与水反应的化学方程式为?。
2H2O+O2↑),则次氟酸与水反应的化学方程式为?。
(2)写出在加热条件下F2(g)跟烧碱反应的化学方程式:?。
(3)判断次氟酸中氧元素的化合价?。
参考答案:(1)HFO+H2O HF↑+H2O2
HF↑+H2O2
(2)2F2+4NaOH 4NaF+O2+2H2O
4NaF+O2+2H2O
(3)0价
本题解析:此题涉及氟的特殊性,具有逆向思维的功能。通常条件下:2F2+2H2O 4HF+O2,显然这与题目信息很不相同,仔细分析,发现它们是有联系的。首先按题目所给予的信息,氟与水反应的方程式为:F2+H2O
4HF+O2,显然这与题目信息很不相同,仔细分析,发现它们是有联系的。首先按题目所给予的信息,氟与水反应的方程式为:F2+H2O HF+HFO,按(1)中“B常用于雕刻玻璃”,则B是HF,有HFO+H2O
HF+HFO,按(1)中“B常用于雕刻玻璃”,则B是HF,有HFO+H2O HF+C,C中显然不含F,而“C在加热下分解生成一种能使带火星的木条复燃的气体”,因2H2O2
HF+C,C中显然不含F,而“C在加热下分解生成一种能使带火星的木条复燃的气体”,因2H2O2 2H2O+O2↑,故C只能是H2O2,因而次氟酸与水反应的方程式为HFO+H2O
2H2O+O2↑,故C只能是H2O2,因而次氟酸与水反应的方程式为HFO+H2O HF↑+H2O2。从中不难看出反应2F2+2H2O
HF↑+H2O2。从中不难看出反应2F2+2H2O 4HF+O2实际上是在较高温度下的反应。至于加热条件下F2(g)跟烧碱反应实质上是HF与NaOH反应。在HFO中氟的化合价只能是-1,氢的化合价只能是+1,故氧的化合价为0。
4HF+O2实际上是在较高温度下的反应。至于加热条件下F2(g)跟烧碱反应实质上是HF与NaOH反应。在HFO中氟的化合价只能是-1,氢的化合价只能是+1,故氧的化合价为0。
本题难度:简单
5、选择题 下列说法正确的是( )
A.向久置的氯水中滴入紫色石蕊试液,溶液将先变红后褪色
B.欲除去氯气中少量氯化氢气体,可将此混合气体通过盛饱和食盐水的洗气瓶
C.漂白粉的有效成分是CaCl2和Ca(ClO)2,应密封保存
D.氯水经光照有气泡逸出,该气体为HCl
参考答案:A.久置的氯水主要成分为HCl,只能使紫色石蕊试液变红,故A错误;
B.氯气难溶于饱和食盐水,HCl极易溶于水,将混合气体通过盛饱和食盐水的洗气瓶,可除去HCl,故B正确;
C.漂白粉的主要成分是CaCl2和Ca(ClO)2,漂白粉的有效成分是Ca(ClO)2,故C错误;
D.氯水光照时HClO分解生成02,该气体为02,故D错误.
故选B.
本题解析:
本题难度:一般