微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是( )
A.加入一种反应物
B.升高温度
C.对平衡体系增加压强
D.使用催化剂
参考答案:A、在反应中,加入一种故体反应物,固体量的增减不会引起化学平衡的移动,故A错误;
B、任何化学反应一定伴随能量的变化,升高温度,化学平衡一定是向着吸热方向进行,故B正确;
C、对于没有气体参加的反应,或是前后气体体积不变的反应,压强不会引起平衡的移动,故C错误;
D、使用催化剂只能改变化学反应的速率,不会引起化学平衡的移动,故D错误.
故选B.
本题解析:
本题难度:一般
2、选择题 一定温度下,在某密闭容器中发生反应:H2(g)+I2(g)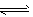 2HI(g)并达到平衡状态。若保持温度不变,在t0时刻改变外界条件,反应速率发生如下图所示的变化。则下列关于反应容器及反应条件变化的说法中正确的是
2HI(g)并达到平衡状态。若保持温度不变,在t0时刻改变外界条件,反应速率发生如下图所示的变化。则下列关于反应容器及反应条件变化的说法中正确的是
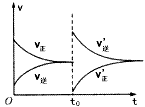
[? ]
A.容器为恒压容器时,充入适量He
B.容器为恒压容器时,充入适量HI
C.容器为恒容容器时,充入适量He
D.容器为恒容容器时,充入适量HI
参考答案:B
本题解析:
本题难度:一般
3、填空题 温室气体二氧化碳减排的一种方法是:从燃煤电厂或天然气电厂排放气中回收CO2,再与CH4热解炉产生的H2反应生成CH3OH.
CO2(g)+3H2(g)
CH3OH(g)+H2O(g)
(1)500℃时,在体积为1L的容积固定的密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
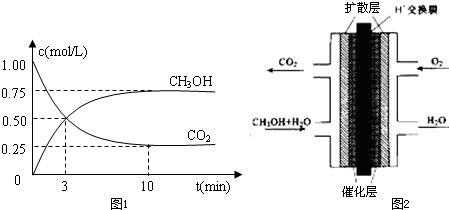
①从反应开始到平衡,氢气的平均反应速率v(H2)=______mol?L-1?min-1.
②该反应的平衡常数K=______(保留一位小数),平衡时H2的转化率为______.
③已知温度升高,K值减小.下列措施中能使增大的是______.
A.升高温度B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离D.再充入1molCO2和3molH2
(2)CH3OH作为内燃机燃料或通过燃料电池驱动车辆.可减少CO2排放多达45%.
①已知:
CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H1=+49.0kJ?mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
则反应CH3OH(g)+O2(g)═CO2(g)+2H2(g)的△H=______kJ?mol-1.
②甲醇质子交换膜燃料电池的结构示意图如图2,已知H+移向通入O2的电极,甲醇进入______极(填“正”或“负”),正极发生的电极反应为______.
参考答案:(1)①由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,故v(CH3OH)=0.75mol/L10min=0.075mol/(L.min),速率之比等于化学计量数之比,故v(H2)=3v(CH3OH)=0.075mol/(L.min)×3=0.225mol/(L.mon),
故答案为:0.225;
②CO2(g)+3H2(g)一定条件
本题解析:
本题难度:一般
4、填空题 (14分)研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义。
(1)I2O5可使H2S、CO、HC1等氧化,常用于定量测定CO的含量。已知:
2I2(s) + 5O2(g)= 2I2O5(s)?△H=-75.56 kJ·mol-1
2CO(g) + O2(g)= 2CO2(g)?△H=-566.0 kJ·mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式:?。
(2)一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是?。
a.体系压强保持不变? b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变? d.每消耗1 mol SO2的同时生成1 molNO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=?。
(3)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为?(写出一种即可)。
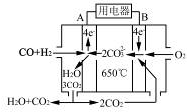
(4)如图是一种碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出B极电极反应式?。
(5)工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应。?
NO + NO2 + Na2CO3 = 2NaNO2 + CO2
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
①用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则混合气体中NO和NO2的体积比为?。
②用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是?。
参考答案:(14分)(每空2分)
(1)5CO(g) + I2O5(s)=5CO2(g) + I2(s)?△H=-1377.22kJ·mol-1
(2)b 2.67或8/3
(3)(NH4)3PO4或(NH4)2HPO4或NH4H2PO4
(4)O2 + 4e-+2CO2 = 2CO32-
(5)①1∶7?
②对于含NO较多混合气体无法完全吸收,因为NO不能与Na2CO3溶液反应
本题解析:能说明反应NO2+SO2 SO3+NO达到平衡状态:压强不变不作为判断依据,SO3和NO的体积比保持不变不可以作为判断的依据。每消耗1 mol SO2的同时消耗1 molNO是平衡状态的标志。平衡常数K=0.82/0.5×1.25=2.67.用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g
SO3+NO达到平衡状态:压强不变不作为判断依据,SO3和NO的体积比保持不变不可以作为判断的依据。每消耗1 mol SO2的同时消耗1 molNO是平衡状态的标志。平衡常数K=0.82/0.5×1.25=2.67.用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g
NO + NO2 + Na2CO3 = 2NaNO2 + CO2
X? X? X
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2?
Y? 0.5y
X+0.5Y=1? /28X+46(X+Y)---44(X+0.5Y)=44?X=1? Y=6
本题难度:一般
5、选择题 汽车上的催化转化器,可将尾气中的主要污染物转化成无毒物质,反应为:
 在某温度时.,用气体传感器测得不同时间的NO和CO浓度如表
在某温度时.,用气体传感器测得不同时间的NO和CO浓度如表
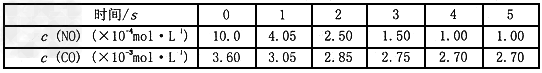
经分析,得出结论不正确的是
[? ]
A. 该反应转化较快,具有存实际意义
B. 催化转化器在冬季时对废气转化效率比夏季更高
C. 2s末的平均反应速率 ?
?
D. 在该温度下,反应的平衡常数K=5000
参考答案:C
本题解析:
本题难度:一般