|
高考化学知识点总结《与量有关的离子方程式的书写》考点特训(2017年冲刺版)(六)
2017-03-03 00:37:14
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式正确的是
A.过量氯气通入碘化亚铁溶液中: Cl2+Fe2++2I-=2Cl-十Fe3+ +I2
B.向NaHCO3溶液中加入少量澄清石灰水:HCO3-+Ca2++OH-=CaCO3↓+H2O
C.H218O中投入少量Na2O2固体:2H218O+2 Na2O2=4Na++4OH-+18O2↑
D.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:
| H+ +SO42-+Ba2+ +OH-==BaSO4↓+ H2O
参考答案:D
本题解析:A不正确,电子的得失不守恒;B中还有碳酸钠生成,C中应该是2H218O+2 Na2O2=4Na++218OH-+2OH-+O2↑,所以正确的答案选D。
点评:判断离子方程式正确与否的方法一般是:(1)检查反应能否发生。(2)检查反应物、生成物是否正确。(3)检查各物质拆分是否正确。(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等)。(5)检查是否符合原化学方程式。
本题难度:一般
2、选择题 下列离子方程式表达正确的是
[?]
A.用惰性电极电解熔融氯化钠:2Cl-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH-
B.用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-==2AlO2-+H2O
C.用稀氢氧化钠溶液吸收二氧化氮:2OH-+2NO2==NO3-+NO↑+H2O
D.用食醋除去水瓶中的水垢:CO32-+2CH3COOH==2CH3COO-+CO2↑+H2O
参考答案:B
本题解析:
本题难度:简单
3、实验题 (15分)雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O3和NH4NO3产品的流程图如下(Ce为铈元素):
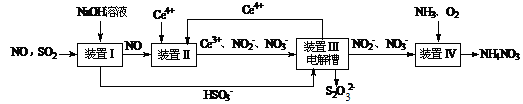
⑴装置Ⅰ中的主要离子方程式为?。3
⑵含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图所示。
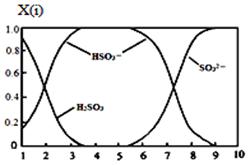 
①若是0.1molNaOH反应后的溶液,测得溶液的pH=8时,溶液中个离子由大到小的顺序是?。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:?。
⑶写出装置Ⅱ中,酸性条件下的离子方程式?。
⑷装置Ⅲ还可以使Ce4+再生,其原理如下图所示。
①生成Ce4+从电解槽的?(填字母序号)口流出。②写出与阴极的反应式?。
⑸已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2?L。(用含a代数式表示, 计算结果保留整数)
参考答案:(1) SO2+OH-=HSO3-;
(2) ①c(Na+)﹥c(SO32-)﹥c(HSO3-)﹥c(OH-)﹥c(H+) ?;② HSO3-在溶液中存在电离平衡:HSO3- SO32-+ H+,加CaCl2溶液后,Ca2++SO32-=CaSO3↓使电离平衡右移,c(H+)增大? SO32-+ H+,加CaCl2溶液后,Ca2++SO32-=CaSO3↓使电离平衡右移,c(H+)增大?
(3) NO+2H2O+3Ce4+=3Ce3++NO3-+4H+;NO+H2O+Ce4+=Ce3++NO2-+2H+
(4)?①a ;?②2HSO3-+4H++4e-=S2O32-+3H2O
(5)243a (242a、244a、5600a/23都给分)
本题解析:⑴在置Ⅰ中SO2与NaOH溶液发生反应,离子方程式是SO2+OH-=HSO3-;(2)①溶液的pH=8时,溶液中含有的物质是Na2SO3和NaHSO3.根据物料守恒可得c(Na+)=(SO32-)+(HSO3-)+(H2O3);所以c(Na+)最大。知c(SO32-)﹥c(HSO3-)由于溶液显碱性,所以c(OH-)﹥c(H+);因为盐是强电解质,盐水解的程度是微弱的,所以c(HSO3-)﹥c(OH-)。故溶液中的离子浓度关系为:c(Na+)﹥c(SO32-)﹥c(HSO3-)﹥c(OH-)﹥c(H+);②NaHSO3溶液的pH=5,说明在溶液中NaHSO3的电离作用大于水解作用,当向其中加入CaCl2溶液时,会发生反应:Ca2++SO32-=CaSO3↓,这样就破坏了溶液中HSO3-在溶液中存在电离平衡:HSO3- SO32-+ H+,使平衡正向移动,进行电离产生大量的H+;c(H+)增大,因此溶液的pH减小。pH降为2。⑶在装置Ⅱ中,在酸性条件下根据流程示意图可得反应的离子方程式是NO+2H2O+3Ce4+=3Ce3++NO3-+4H+;NO+H2O+ Ce4+=Ce3++NO2-+2H+;⑷在装置Ⅲ还可以使Ce4+再生,①由于Ce3+→Ce4+,化合价升高,失去电子,所以生成Ce4+从电解槽的阳极a流出;②在阴极发生的电极的反应式是2HSO3-+4H++4e-=S2O32-+3H2O。⑸由于NO2-的浓度为a g·L-1,所以1 m3该溶液中的NO2-的量为a g·L-1×1000L=1000ag.物质的量为1000ag÷46g/mol;每1mol的NO2-完全转化为NH4NO3,失去电子2mol.所以转移电子的物质的量为1000ag÷46g/mol×2=(1000a÷23)mol,每一mol的氧气反应转移电子4mol,所以消耗氧气的物质的量为(1000a÷23)mol÷4=(250a÷23)mol,需至少向装置Ⅳ中通入标准状况下的O2的体积是(250a÷23)mol×22.4L/mol=5600a/23L="243." 5aL。 SO32-+ H+,使平衡正向移动,进行电离产生大量的H+;c(H+)增大,因此溶液的pH减小。pH降为2。⑶在装置Ⅱ中,在酸性条件下根据流程示意图可得反应的离子方程式是NO+2H2O+3Ce4+=3Ce3++NO3-+4H+;NO+H2O+ Ce4+=Ce3++NO2-+2H+;⑷在装置Ⅲ还可以使Ce4+再生,①由于Ce3+→Ce4+,化合价升高,失去电子,所以生成Ce4+从电解槽的阳极a流出;②在阴极发生的电极的反应式是2HSO3-+4H++4e-=S2O32-+3H2O。⑸由于NO2-的浓度为a g·L-1,所以1 m3该溶液中的NO2-的量为a g·L-1×1000L=1000ag.物质的量为1000ag÷46g/mol;每1mol的NO2-完全转化为NH4NO3,失去电子2mol.所以转移电子的物质的量为1000ag÷46g/mol×2=(1000a÷23)mol,每一mol的氧气反应转移电子4mol,所以消耗氧气的物质的量为(1000a÷23)mol÷4=(250a÷23)mol,需至少向装置Ⅳ中通入标准状况下的O2的体积是(250a÷23)mol×22.4L/mol=5600a/23L="243." 5aL。
考查:离子方程式的书写、离子浓度的比较、电解原理及应用、氧化还原反应的有关计算的知识。
本题难度:一般
4、选择题 下列离子方程式正确的是
[? ]
A.氯化铁的水解反应:Fe3++3H2O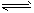 Fe(OH)3↓+3H+ Fe(OH)3↓+3H+
B.漂白粉溶液在空气中失效:ClO-+CO2+H2O==HClO+HCO3-
C.小苏打与醋酸溶液混合:HCO3- + CH3COOH == CH3COO- + CO2↑ + H2O
D.常温下,向Ba(OH)2溶液中滴入NaHSO4溶液至pH=7:Ba2++OH-+H++SO42-== BaSO4↓+H2O
参考答案:C
本题解析:
本题难度:一般
5、填空题 (1)填写下表
物质(杂质)
| 除去杂质
所需试剂或方法
| 离子方程式
(若无离子方程式,则写化学方程式)
| Fe(Al)
| ?
| ?
| SiO2(CaCO3)
| ?
| ?
| CO2(HCl)
| ?
| ?
| NaHCO3溶液(Na2CO3)
| ?
| ?
| Na2CO3(NaHCO3)
| ?
| ?
| Al2O3(Al(OH)3)
| ?
| ?
|
?
(2)将二氧化硫通入到氯化钡溶液中未见到明显现象,继续通入向该溶液中滴加氯水或氨水,均见到白色沉淀产生,该沉淀的成分分别为?或?,请分别写出发生反应的离子方程式?,?。
参考答案:(15分)(1)
物质(杂质)
除去杂质所需试剂
离子方程式
Fe(Al)
氢氧化钠溶液
2Al+ 2OH-+ 2H2O=AlO2-+ 3H2↑
SiO2(CaCO3)
盐酸
CaCO3+ 2H+= Ca2+ + CO2↑+ H2O
CO2(HCl)
饱和碳酸氢钠溶液
HCO3-+ H+=H2O+ CO2↑
NaHCO3溶液(Na2CO3)
CO2
CO32-+ CO2+ H2O=2HCO3-
Na2CO3(NaHCO3)
氢氧化钠溶液
或加热
HCO3-+ OH-=CO32-+ H2O
或2NaHCO3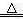 Na2CO3+CO2↑+ H2O Na2CO3+CO2↑+ H2O
Al2O3(Al(OH)3)
加热
2Al(OH)3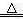 Al2O3+3H2O Al2O3+3H2O
?
(2)BaSO4?BaSO3? Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-?
Ba2++2NH3+H2O+SO2=BaSO3↓+2NH4+
本题解析:(1)铁、铝均是金属活动顺序表中氢前金属,都能溶于稀盐酸,铁不能溶于氢氧化钠溶液,而铝能溶于氢氧化钠溶液,生成偏铝酸钠和氢气,因此氢氧化钠溶液可以除去铁中混入的少量铝;二氧化硅不溶于水和盐酸,碳酸钙难溶于水,易溶于盐酸,生成氯化钙、二氧化碳和水,因此盐酸可以除去二氧化硅中混入的碳酸钙;二氧化碳不能与碳酸氢钠反应,其溶解度较小,难溶于饱和碳酸氢钠,氯化氢的溶解度较大,易溶于饱和碳酸氢钠,且与之反应生成氯化钠、二氧化碳和水,因此可用饱和碳酸氢钠溶液除去CO2中混入的HCl;CO2与Na2CO3溶液能反应生成NaHCO3,因此可以通入足量CO2气体除去碳酸氢钠溶液中混有的碳酸钠;碳酸氢钠可以转化为碳酸钠,加入适量的NaOH中和碳酸氢钠,或者加热,使不稳定的碳酸氢钠分解为碳酸钠、二氧化碳和水;氧化铝稳定,氢氧化铝受热易分解为氧化铝和水;(2)、二氧化硫具有还原性,也具有酸性氧化物的通性,氯水能氧化SO2,NH3能中和SO2;前者出现白色沉淀的原因是SO2+Cl2+2H2O=4H++2Cl-+SO42—,Ba2++SO42—=BaSO4↓,后者的原因是SO2+2NH3+2H2O=2NH4++SO32—、Ba2++SO32—=BaSO4↓。
本题难度:一般
|