微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)平衡常数K表示可逆反应的进行程度,K值越大,表示______
(2)大小与温度的关系是:温度升高,K值______(填一定增大、一定减小、或可能增大也可能减小).
参考答案:(1)平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,K越大,说明生成物越多,反应物越少,所以可逆反应进行的程度越大,故答案为:可逆反应进行的程度越大;
(2)当反应放热时,升高温度平衡向逆反应方向移动,当反应吸热时,升高温度平衡向正反应方向移动,温度升高,K可能增大,也可能减小,
故答案为:可能增大也可能减小.
本题解析:
本题难度:一般
2、选择题 下列各项表述与示意图一致的是( )
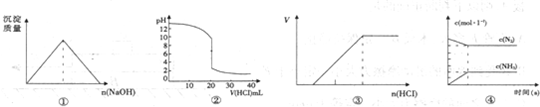
A.图①表示向AlCl3溶液中滴入NaOH溶液,沉淀质量变化
B.图②表示25℃时,用0.01mol?L-1盐酸滴定20mL0.01mol?L-1NaOH溶液,溶液的PH随加人酸体积的变化
C.图③表示向Na2CO3稀溶液中滴入稀HCl,产生气体的量随加人盐酸量的变化关系
D.图④中曲线表示合成氨反应组分浓度随时间的变化关系
参考答案:D
本题解析:
本题难度:一般
3、简答题 TDI、MDI等精细化工使用的H2可以通过天然气来制取,其生产流程如图1:
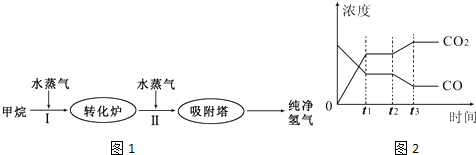
(1)此流程的第I步反应为:CH4(g)+H2O(g)?CO(g)+3H2(g),100℃时,将1molCH4和2molH2O(g)通入容积为100L的恒容密闭容器中,达到平衡时CH4的转化率为0.5.此时该反应的平衡常数K=______.
(2)此流程的第II步反应:CO(g)+H2O(g)?CO2(g)+H2(g)的平衡常数随温度的变化如下表:
从上表可以推断:该反应是______反应(填“吸热”或“放热”).若该反应在500℃时进行,设起始时CO和H2O的浓度均为0.020mol/L,反应达到平衡时,CO的转化率为______.如图2表示该反应在t1时刻达到平衡,在t2时刻因改变某个条件引起浓度变化的情况,如图2中t2时刻发生改变的条件是______(写出一种).
参考答案:(1)100℃时,将1molCH4和2molH2O通入容积为100L的恒容密闭容器中,达到平衡时CH4的转化率为0.5,
CH4(g)+H2O(g)?CO(g)+3H2(g)
起始量(mol/L) 0.01 0.02 0 0
变化量(mol/L) 0.0050.005 0.005 0.015
平衡量(mol/L) 0.005 0.015 0.005 0.015
化学平衡常数K=c(CO).c3(H2)c(CH4).c(H2O)=0.005×(0.015)30.005×0.015=2.25×10-4 ,故答案为:2.25×10-4 ;
(2)随着温度的升高,化学平衡常数减小,说明平衡向逆反应方向移动,则正反应是放热反应;
设CO的转化率为x,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始0.02mol/L 0.02mol/L 00
反应0.02xmol/L 0.02xmol/L 0.02xmol/L0.02xmol/L
平衡0.02(1-x)mol/L0.02(1-x)mol/L 0.02xmol/L 0.02xmol/L
化学平衡常数K=0.02x×0.02x[0.02×(1-x)]2=9,x=75%;
在t2时刻CO的浓度减小、CO2浓度增大,平衡向正反应方向移动,且CO和CO2浓度变化有接触点,所以可以通过改变降低温度、增大水蒸气的量或减少氢气的量实现,
故答案为:放热;75%;降低温度或增加水蒸气的量或减少氢气的量.
本题解析:
本题难度:一般
4、选择题 已知450℃时,反应H2(g)+I2(g) 2HI(g)的K=50,由此推测在450℃时,反应2HI(g)
2HI(g)的K=50,由此推测在450℃时,反应2HI(g)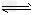 H2(g)+I2(g)的化学平衡常数为
H2(g)+I2(g)的化学平衡常数为
[? ]
A.50?
B.0.02?
C.100?
D.无法确定
参考答案:B
本题解析:
本题难度:简单
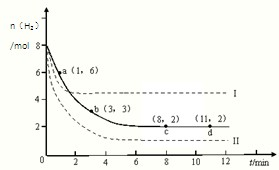
5、选择题 已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1现将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示.以下说法不正确的是( )
CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1现将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示.以下说法不正确的是( )
A.0~1min的平均反应速率大于3~4min的平均反应速率
B.达到平衡时H2的转化率为75%
C.在其它条件不变时,曲线II的条件改变为使用催化剂
D.在其它条件不变时,曲线I的条件改变为升高温度