| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《化学平衡常数》考点巩固(2017年最新版)(八)
 参考答案:C 本题解析: 本题难度:简单 2、选择题 汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ?mol-1,在恒容的密闭容器中,反应达到平衡后,当改变其中一个条件X,Y随X的变化,符合图中曲线的是( ) |

参考答案:D
本题解析:
本题难度:一般
3、填空题 中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~45%。
(1)有效“减碳”的手段之一是节能。下列制氢方法最节能的是___________。(填字母序号)
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O CO+3H2
CO+3H2
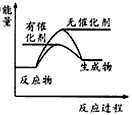
(2)CO2加氢合成DME(二甲醚)是解决能源危机的研究方向之一。2CO2(g)+6H2(g)→CH3OCH3(g)+3H2O;△H>0。请在坐标图中画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意罔,并进行必要标注。 
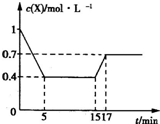
(3)CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入1molCO2和3 molH2,一定条件下发生反应:CO2(g)+3H2(g)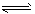 CH3OH(g)+H2O(g);△H=-49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如右上图所示。 ①从3 min到10min,v(H2) =___________mol/(L·min)。②能说明上述反应达到平衡状态的是___________(填编号)。
CH3OH(g)+H2O(g);△H=-49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如右上图所示。 ①从3 min到10min,v(H2) =___________mol/(L·min)。②能说明上述反应达到平衡状态的是___________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1:1 (即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗3 molH2,同时生成1 molH2O
D.CO2的体积分数在混合气体中保持不变 
(4)工业上CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g)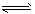 CH3OH(g)的平衡常数:
CH3OH(g)的平衡常数: 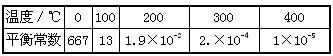
下列说法正确的是_______。
a.该反应正反应是放热反应
b.该反应在低温下不能自发进行,高温下可自发进行,说明该反应
c.在T℃时,1L密闭容器中,投入0.1 mol CO和0.2 mol H2,达到平衡时,CO转化率为40%,则此时的平衡常数约为46.3
d.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高
参考答案:(1)C
(2)
(3)①0.11②D
(4)ac
本题解析:
本题难度:一般
4、选择题 一定温度下,反应N2(g)+3H2(g)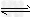 ?2NH3(g)的反应热和化学平衡常数分别为△H和K,?则相同温度时反应4NH3(g)
?2NH3(g)的反应热和化学平衡常数分别为△H和K,?则相同温度时反应4NH3(g)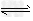 ?2N2(g)+6H2(g)反应热和化学平衡常数为
?2N2(g)+6H2(g)反应热和化学平衡常数为
[? ]
A.2△H和2K?
B.-2△H和?K2?
C.-2△H和?K-2?
D.2△H和-2K?
参考答案:C
本题解析:
本题难度:一般
5、简答题 将CoCl2溶于浓盐酸中能形成CoCl42-.溶液中存在如下平衡:CoCl42-(蓝色)+6H2O?Co(H2O)62+(粉红色)+4Cl-.
(1)一般情况下,CoCl2溶液呈紫色,将盛有CoCl2溶液的试管放在热水中溶液逐渐变成蓝色,则正反应方向为______反应(填“吸热”或“放热”).
(2)该反应平衡常数表达式为______,加水稀释平衡向______方向(填“正”或“逆”)移动.
(3)向溶液中加入少量AgNO3固体,溶液颜色变为______色.
参考答案:(1)盛有CoCl2溶液的试管放在热水中溶液逐渐变成蓝色,则上述平衡逆向移动,即升高温度平衡逆向移动,则正反应为放热反应,故答案为:放热;
(2)K为生成物浓度幂之积与反应物浓度幂之积的比,则K=c[Co(H2O)62+]×c4[Cl-]c[CoCl42-],加水稀释促进水解,即稀释平衡正向移动,
故答案为:c[Co(H2O)62+]×c4[Cl-]c[CoCl42-];正;
(3)加入少量AgNO3固体,与氯离子反应生成沉淀,使上述平衡正向移动,Co(H2O)62+浓度增大,溶液为粉红色,故答案为:粉红.
本题解析:
本题难度:一般
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高考化学知识点总结《常用仪器及.. | ||