|
高考化学知识点整理《有关氧化还原反应的计算》高频试题巩固(2017年最新版)(二)
2017-03-03 00:40:51
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列解释实验现象的反应方程式正确的是
A.SO2通入到滴加酚酞的NaOH溶液中,红色变浅:SO2+2NaOH=Na2SO4+H2O
B.向K2Cr2O7溶液中加入少量NaOH浓溶液,溶液由橙色变为黄色:Cr2O72—+H2O 2CrO42—+2H+ 2CrO42—+2H+
C.等浓度的NH4Al(SO4)2溶液与Ba(OH)2溶液以1:2体积比混合出现白色沉淀:Al3++2SO42-+2Ba2++3OH-=2BaSO4↓+Al(OH)3↓
D.铝热反应的原理为:Al2O3+2Fe 2Al+Fe2O3 2Al+Fe2O3
参考答案:B
本题解析:A.氧元素元素不守恒;相关化学方程式:SO2+2NaOH=Na2SO3+H2O;C.漏写物质NH3·H2O:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O。 D.铝热反应的原理为:Fe2O3+2Al高温 2Fe+Al2O3。
本题难度:一般
2、选择题 将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是
A.加入合金的质量可能为9.6g
B.沉淀完全时消耗NaOH溶液体积为150mL
C.参加反应的硝酸的物质的量为0.4mol
D.溶解合金时产生NO气体体积0.224L
|
参考答案:C
本题解析:原合金的质量是Mg和Cu的质量,当把合金加入到硝酸中,金属变为Mg2+、Cu2+离子,向反应后的溶液中加入NaOH溶液,当金属离子沉淀完全时,得到的沉淀是Mg(OH)2、Cu(OH)2,增加的质量是OH-的质量。m(OH-)="5.1" g,则n(OH-)="5.1" g÷17g/mol=0.3mol,在反应过程中金属失去电子的物质的量与硝酸变为NO时得到电子的物质的量相等,也等于氢氧根离子的物质的量。A.Mg、Cu都是+2价的金属,若金属完全是Cu则其质量是(0.3mol÷2)×64g/mol=9.6g。若完全是Mg,则金属的质量是(0.3mol÷2)×24g/mol=3.6g。由于是Mg与Cu的合金,所以质量在2.4g—9.6g之间,错误;B.沉淀完全时消耗NaOH溶液体积为0.3mol ÷3mol/L =0.1L=100mL,错误;C.参加反应的硝酸的作用有两个,提供酸根离子,形成盐;作氧化剂,得到电子变为NO,起酸作用的硝酸的物质的量是:n(HNO3)(酸)= n(OH-)=0.3mol,起氧化剂作用的硝酸的物质的量是:n(HNO3)(氧化性)= 0.3mol÷3=0.1mol,所以发生反应消耗的硝酸的物质的量为0.3mol+0.1mol=0.4mol,正确;D.溶解合金时产生NO气体的物质的量是0.3mol÷3=0.1mol,由于没有指明反应条件,所以无法确定气体体积的大小,错误。
考点:考查守恒方法在氧化还原反应的计算中的应用的知识。
本题难度:一般
3、填空题 氮氧化物是大气污染物之一,消除氮氧化物的方法有多种。
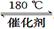
(1)利用甲烷催化还原氮氧化物。已知:
①CH4 (g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H =-574 kJ/mol
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H =-1160 kJ/mol
则CH4 将NO2 还原为N2 的热化学方程式为: 。
(2)利用NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。 反应的化学方程式为: 为提高氮氧化物的转化率可采取的措施是 (写出1条即可)。 为提高氮氧化物的转化率可采取的措施是 (写出1条即可)。
(3)利用ClO2氧化氮氧化物。其转化流程如下: NO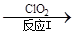 NO2 NO2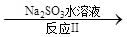 N2。已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O =NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是 ;若生成11.2 L N2(标准状况),则消耗ClO2 g 。 N2。已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O =NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是 ;若生成11.2 L N2(标准状况),则消耗ClO2 g 。
(4)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g) N2 (g)+CO2 (g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下: N2 (g)+CO2 (g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol?L-1/
时间/min
| NO
| N2
| CO2
| 0
| 0.100
| 0
| 0
| 10
| 0.058
| 0.021
| 0.021
| 20
| 0.040
| 0.030
| 0.030
| 30
| 0.040
| 0.030
| 0.030
| 40
| 0.032
| 0.034
| 0.017
| 50
| 0.032
| 0.034
| 0.017
|
①T1℃时,该反应的平衡常数K= (保留两位小数).②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 .③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H 0(填“>”、“=”或“<”).
参考答案:(1)CH4 (g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H =-867 kJ/mol
(2)增大NH3的浓度或减小反应体系的压强或降低反应体系的温度等
(3)2NO2 + 4 Na2SO3=N2 + 4 Na2SO4 67.5 (4)①0.56 ② 减少CO2浓度 ③ <
本题解析:(1)(①+②)÷2可得CH4 (g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H =-867 kJ/mol。(2)由于反应 的正反应气体体积增大的放热反应。所以提高氮氧化物的转化率可采取的措施可以是通过增大NH3的浓度或减小反应体系的压强或降低反应体系的温度等措施来实施。(3)由题目提供的信息可知NO2与Na2SO3发生氧化还原反应:2NO2 + 4 Na2SO3 =N2 + 4 Na2SO4,从而消除了NOx对环境造成的污染。由方程式得关系式:2ClO2~2NO2~N2。n(N2)=0.5mol,所以n(ClO2)=1mol,m(ClO2)=1mol×67.5g/mol=67.5g。(4)①T1℃时,该反应的平衡常数 的正反应气体体积增大的放热反应。所以提高氮氧化物的转化率可采取的措施可以是通过增大NH3的浓度或减小反应体系的压强或降低反应体系的温度等措施来实施。(3)由题目提供的信息可知NO2与Na2SO3发生氧化还原反应:2NO2 + 4 Na2SO3 =N2 + 4 Na2SO4,从而消除了NOx对环境造成的污染。由方程式得关系式:2ClO2~2NO2~N2。n(N2)=0.5mol,所以n(ClO2)=1mol,m(ClO2)=1mol×67.5g/mol=67.5g。(4)①T1℃时,该反应的平衡常数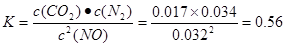 .②由表中数据可以看出30min后,c(CO2)减小,c(N2)却逐渐增加c(NO)有所减少。说明改变的条件是减小c(CO2)。③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3, .②由表中数据可以看出30min后,c(CO2)减小,c(N2)却逐渐增加c(NO)有所减少。说明改变的条件是减小c(CO2)。③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,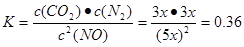 <0.56。说明升高温度,化学平衡向逆反应方向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。逆反应方向为吸热反应,所以该反应的正反应为放热反应。则该反应的△H <0. <0.56。说明升高温度,化学平衡向逆反应方向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。逆反应方向为吸热反应,所以该反应的正反应为放热反应。则该反应的△H <0.
考点:考查化学方程式、热化学方程式的书写、化学平衡常数的计算、外界条件对化学平衡移动的影响。
本题难度:困难
4、选择题 下列各物质的化学式、名称(或俗名)、分类都正确的是?(?)
A.FeO氧化铁碱性氧化物
B.Na2CO3小苏打盐
C.KAl(SO4)2.12H2O明矾盐
D.CuSO4硫酸铜酸
参考答案:C
本题解析:略
本题难度:简单
5、选择题 下列反应中,水只作氧化剂的是
A.2Na+2H2O ="=" 2NaOH +H2↑
B.2F2 +2H2O ="=" 4HF + O2
C.Cl2+H2O ="=" HCl +HClO
D.SO2 + H2O ="=" H2SO3
参考答案:A
本题解析:分析:有元素化合价变化的化学反应是氧化还原反应,化合价降低的反应物作氧化剂,水只作氧化剂说明水中的氢元素化合价降低(注意氧元素化合价不能再降低).
解答:解:A、2Na+2H2O=2NaOH+H2↑反应中氢元素化合价降低,所以该反应是氧化还原反应且水作氧化剂,故A正确.
B、2F2+2H2O=4HF+O2↑反应中水中氧元素化合价升高,所以该反应是氧化还原反应,但水中的氢元素化合价不变,所以水只作还原剂,故B错误.
C、Cl2+H2O=HCl+HClO反应中氯元素的化合价部分升高部分降低,所以该反应是氧化还原反应,但水中的氢、氧元素化合价不变,所以水既不做氧化剂也不做还原剂,故C错误.
D、SO2 + H2O ="=" H2SO3反应中各元素的化合价不变,所以不是氧化还原反应,故D错误.
故选A.
本题难度:简单
|