微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 A、X、Y、Z和W是原子序数依次增大的五种短周期元素.A和X可组成两种常温下为液态的化合物A2X、A2X2,X和Y也可组成两种常温下为固体的化合物Y2X、Y2X2,且Y2X、Y2X2的焰色反应均为黄色.在元素周期表中,A与Y同主族,X与Z相邻,Z与W相邻.请回答:
(1)A2X2的结构式______,Y2X2的电子式______.
(2)X、Z两种元素的氢化物中熔沸点较高的是______(填化学式,下同);Z、W两种元素的最高价氧化物对应的水化物中酸性较强的是______.
(3)W元素在周期表中的位置为______;实验室制备W单质的化学反应方程式为______;在上述反应中每生成1molW单质,转移的电子数目为______NA.
参考答案:A、X、Y、Z和W是原子序数依次增大的五种短周期元素.A和X可组成两种常温下为液态的化合物A2X、A2X2,应是H2O、H2O2,则A为H、X为O;X和Y也可组成两种常温下为固体的化合物Y2X、Y2X2,且Y2X、Y2X2的焰色反应均为黄色,含有Na元素,则Y为Aa;在元素周期表中,X与Z相邻,Z与W相邻,结合原子序数可知,Z、W处于第三周期,由位置关系可推知X、Z应同主族,故Z为S、W为Cl,
(1)A2X2为H2O2,分子中O原子之间形成1对共用电子对,O原子与H原子之间形成1对共用电子对,故其结构式为H-O-O-H,Y2X2为Na2O2,由钠离子与过氧根离子构成,过氧根离子中氧原子之间形成1对共用电子对,且氧原子满足8电子结构,其电子式为: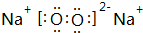 ,
,
故答案为:H-O-O-H; ;
;
(2)X、Z两种元素的氢化物分别为H2O、H2S,H2S分子之间存在范德华力,H2O分子之间存在氢键,氢键比范德华力作用更强,故H2O的熔沸点较高;Z、W两种元素的最高价氧化物对应的水化物分别为:H2SO4,HClO4,非金属性Cl>S,故HClO4酸性较强,
故答案为:H2O;HClO4;
(3)W为Cl元素,在周期表中的位置为:第三周期ⅦA族;实验室通常用二氧化锰与浓盐酸在加热条件下制备氯气,反应化学反应方程式为:MnO2+4HCl(浓)△.MnCl2+Cl2↑+2H2O,反应中氧化产物只有氯气,Cl元素化合价由-1价升高为0价,故在上述反应中每生成1mol氯气,转移的电子数目为2NA,
故答案为:第三周期ⅦA族;MnO2+4HCl(浓)△.MnCl2+Cl2↑+2H2O;2.
本题解析:
本题难度:一般
2、填空题 (I)多项选择题
下列说法中正确的是?。
A.丙烯分子中有8个σ键,1个π键
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力
D.NCl3和BC13分子中,中心原子都采用sp3杂化
E.SO3与CO32-互为等电子体,SO3是极性分子
(II)人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第________周期第________族;其基态原子的电子排布式为________。
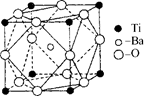
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如右图所示,它的化学式是?,其中Ti4+的氧配位数为?,Ba2+的氧配位数为?,
(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4是?晶体。
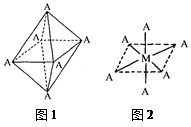
4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如下图1所示,我们通常可以用下图2所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有?种同分异构体。
(Ⅲ)
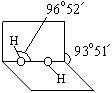
(1)已知过氧化氢分子的空间结构如右图所示,分子中氧原子采取?杂化。
(2)R是1~36
号元素中未成对电子数最多的原子。R3+在溶液中存在如下转化关系:
R3+ 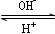 ?R(OH)3
?R(OH)3 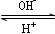 ?[R(OH)4]-
?[R(OH)4]-
①基态R原子的价电子排布式为?;
②[R(OH)4]-中存在的化学键是?。
A.离子键? B.极性键? C.非极性键? D.配位键
参考答案:(共13分) Ⅰ (1) AC (2分)
Ⅱ (1) 四(1分)? IVB(1分)? [Ar]3d24s2(1分)
(2)BaTiO3(1分)? 6(1分)? 12(1分)
(3)分子(1分) (4)2(1分)
Ⅲ (1)sp3(1分);H2O2分子与水分子间形成氢键(1分);
(2)①3d54s1(1分);② BD(1分)
本题解析:略
本题难度:一般
3、选择题 X、Y、Z和W为原子序数依次增大的四种短周期元素.已知:①在元素周期表中,Z与X、W直接相邻;②X、Z和W三种元素原子最外层电子数之和为19,Y为同周期中原子半径最小.下列各选项正确的是( )
A.离子的还原性:Z<Y
B.水溶液的酸性:HY>HW
C.漂白作用:WX2>HWX
D.与水反应:Y2+H2O?HY+HYO
参考答案:X、Y、Z和W为原子序数依次增大的四种短周期元素.Z与X的原子序数相差≥2,在元素周期表中,Z与X、W直接相邻,则Z、X不可能处于同一周期,故X、Z处于同族,X、Z和W三种元素原子最外层电子数之和为19,所以Z、X、W不可能处于同族,故Z、W处于同一周期,令Z、X的最外层电子数为a,则W的最外层电子数为a+1,所以a+a+a+1=19,解得a=6,故X为氧元素,Z为硫元素,W为氯元素.Y的原子序数介于氧元素与硫元素之间,Y为同周期中原子半径最小,故Y为氟元素.
A、元素非金属性越强,相应阴离子的还原性越弱,F元素的金属性可能比S元素强,故Y阴离子的还原性可能比S2-弱,故A错误;
B、Y为F元素、W为氯元素,氢氟酸为弱酸,盐酸为强酸,故B错误;
C、W为氯元素,ClO2的氧化能力大于HClO,所以漂白能力ClO2>HClO,故C正确;
D、氟气与水反应生成氢氟酸与氧气,故D错误.
故选:C.
本题解析:
本题难度:一般
4、选择题 下列说法正确的是
[? ]
A.含有非极性键的分子一定是非极性分子
B.非极性分子中一定含有非极性键
C.由极性键形成的双原子分子一定是极性分子
D.键的极性与分子的极性无关
参考答案:C
本题解析:
本题难度:简单
5、选择题 下列有关化学用语表示正确的是
[? ]
A.水分子的球棍模型: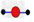 ? ?
? ?
B.S2-的结构示意图: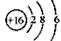 ?
?
C.质子数为53,中子数为78的碘原子:13153I?
D.N2的电子式: 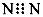
参考答案:C
本题解析:
本题难度:简单