微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列热化学方程式书写正确的是?
A.2SO2+O2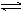 2SO3; △H=-196.6kJ/mol
2SO3; △H=-196.6kJ/mol
B.C(s)+O2(g)==CO2(g);△H=393.5kJ/mol
C.1/2H2(g)+1/2Cl2(g)==HCl(g);△H=-92.5kJ/mol
D.H+(aq)+OH-(aq)==H2O(l);△H=57.3kJ
参考答案:C
本题解析:略
本题难度:简单
2、填空题 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示( 图中的△H表示生成1mol产物的数据)。根据图示,回答下列问题:
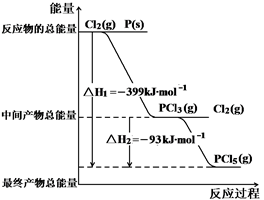
⑴P和Cl2反应生成PCl3(g)的热化学方程式?。
⑵PCl5(g)分解成PCl3(g)和Cl2的热化学方程式?。
⑶白磷能自燃,红磷不能自燃。白磷转变成红磷为?(“放”或“吸”) 热反应。如果用白磷替代红磷和Cl2反应生成1molPCl5的△H3,则△H3?△H1 (填“<”、“>” 或 “=”)。
参考答案:(1)P(s)+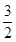 Cl2(g)=PCl3(g)△H="-306" kJ/mol
Cl2(g)=PCl3(g)△H="-306" kJ/mol
(2)PCl5(g)=PCl3(g)+Cl2(g)△H="+93" kJ/mol?(3)放;<
本题解析:(1)根据图示可知:P(s)+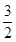 Cl2(g)=PCl3(g),反应物的总能量大于生成物的总能量,该反应是放热反应,反应热为△H=-306 kJ/mol,则热化学方程式为:P(s)+
Cl2(g)=PCl3(g),反应物的总能量大于生成物的总能量,该反应是放热反应,反应热为△H=-306 kJ/mol,则热化学方程式为:P(s)+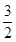 Cl2(g)=PCl3(g)△H="-306" kJ/mol。
Cl2(g)=PCl3(g)△H="-306" kJ/mol。
(2)根据图示可知:Cl2(g)+PCl3(g)=PCl5(g),中间产物的总能量大于最终产物的总能量,该反应是放热反应,△H=生成物总能量-反应物总能量=-93 kJ/mol;所以PCl5(g)=PCl3(g)+Cl2(g)是吸热反应;热化学方程式:PCl5(g)=PCl3(g)+Cl2(g)△H="+93" kJ/mol。
(3)白磷能自燃,红磷不能自燃,这说明白磷的总能量高于红磷的总能量,因此白磷转变成红磷为放热反应。由于白磷总能量高于红磷总能量,所以如果用白磷替代红磷和Cl2反应生成1molPCl5时放出的热量多,则反应热△H3<△H1。
本题难度:一般
3、选择题 反应A(g)+B(g)? ?C(g)+D(g)过程中的能量变化如图所示,由此可判断(?)
?C(g)+D(g)过程中的能量变化如图所示,由此可判断(?)
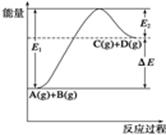
A.1molA与1molB充分反应后,能量变化为ΔE
B.加入催化剂后,反应加快,ΔE减小
C.反应物的总键能小于生成物的总键能
D.反应达到平衡时,升高温度,A的转化率增大
参考答案:D
本题解析:A、1molA(g)与1molB(g)充分反应后生成1mol?C(g)与1molD(g),能量变化为ΔE,错误;B、加入催化剂后,反应加快,E1、E2减小,ΔE不变,错误;C、由题给图像知,反应物的总键能大于生成物的总键能,错误;D、由题给图像知,该反应为吸热反应,反应达到平衡时,升高温度,平衡正向移动,A的转化率增大,正确。
本题难度:一般
4、填空题 某同学进行如下实验 ,检验化学反应中的能量变化.
实验中发现反应前后①中的温度升高而②中的温度降低,由此判断Al与盐酸的反应是______热反应、Ba(OH)2?8H2O与NH4Cl的反应是______热反应.试写出①中反应的离子方程式:______.
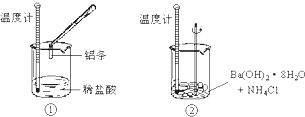
参考答案:通过实验测出,反应前后①烧杯中的温度升高,②烧杯中的温度降低,根据温度升高,反应放热,温度降低,反应吸热,所以Al跟盐酸的反应是放热反应,Ba(OH)2?8H2O跟NH4Cl的反应是吸热反应,Al跟盐酸反应方程式为:2Al+6HCl═2AlCl3+3H2↑,则离子方程式为:2Al+6H+═2Al3++3H2↑,
故答案为:放;吸;2Al+6H+═2Al3++3H2↑.
本题解析:
本题难度:一般
5、选择题 已知一定温度下合成氨反应: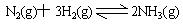 ;△H=—92.4kJ·mol—1。在相同温度、相同体积的密闭容器中进行如下实验:①通入1molN2和3molH2达平衡时放出热量为Q1;②通入2molN2和6molH2,达平衡时放出热量为Q2,则下列关系正确的是( )
;△H=—92.4kJ·mol—1。在相同温度、相同体积的密闭容器中进行如下实验:①通入1molN2和3molH2达平衡时放出热量为Q1;②通入2molN2和6molH2,达平衡时放出热量为Q2,则下列关系正确的是( )
A.Q2=2Q1
B.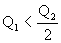
C.Q1<Q2<184.8kJ
D.Q1=Q2<92.4kJ
参考答案:BC
本题解析:假设第2种情况下容积为第1情况的2倍,则Q2=2Q1,但本题中两种情况下容积相同,所以需要把假设情况的容积压缩,使平衡右移,放出的热量Q2增大,所以Q2<2Q1。同时,由于反应不能进行到底,所以Q2<184.4kJ。
本题难度:简单