|
高中化学知识点讲解《与量有关的离子方程式的书写》高频试题强化练习(2017年最新版)(八)
2017-03-03 00:56:34
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式的书写正确的是
A.弱酸尼泊金酸( )与碳酸氢钠溶液反应 )与碳酸氢钠溶液反应

B.将0.01mol氯气通入10 mL 1 mol / L的FeBr2溶液中2Fe2++2Br-+3Cl2→2Fe3++6Cl-+Br2
C.向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液 Ca2++ HCO3- +OH-→CaCO3↓+H2O
D.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至Ba2+刚好沉淀完全
| Ba2++2OH-+H++ SO42- + NH4+ → BaSO4↓+ NH3·H2O +H2O
参考答案:AD
本题解析:略
本题难度:一般
2、选择题 下列表示对应化学反应的离子方程式正确的是( )
A.向含有Fe2O3悬浊液中通入HI:Fe2O3+6H+ 2Fe3++3H2O
B.NaHSO4溶液中滴入Ba(OH)2溶液至SO42-完全沉淀:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
C.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2↑
D.将1?mol/L?NaAlO2溶液和1.5?mol/L?HCl溶液等体积互相均匀混合:6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+
参考答案:A.向含有Fe2O3悬浊液中通入HI的离子反应为Fe2O3+2I-+6H+═2Fe2++I2+3H2O,故A错误;
B.NaHSO4溶液中滴入Ba(OH)2溶液至SO42-完全沉淀的离子反应为H++SO42-+Ba2++OH-=BaSO4↓+H2O,故B错误;
C.醋酸溶液与水垢中的CaCO3反应的离子反应为CaCO3+2HAc=Ca2++2Ac-+H2O+CO2↑,故C错误;
D.将1?mol/L?NaAlO2溶液和1.5?mol/L?HCl溶液等体积互相均匀混合的离子反应为6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+,故D正确;
故选D.
本题解析:
本题难度:简单
3、选择题 下列氧化还原反应的离子方程式中正确的是?( ?)
A.Cl2+6OH-=Cl-+ClO3-+3H2O
B.2Cl2+6OH-=3Cl-+ClO3-+3H2O
C.3Cl2+6OH-=5Cl-+ClO3-+3H2O
D.4Cl2+6OH-=7Cl-+ClO3-+3H2O
参考答案:C
本题解析:A、电荷不守恒,左6-,右2-; B、电荷不守恒,左6-,右4-; D、电荷不守恒,左6-,右8-。
本题难度:一般
4、选择题 描述或解释下列现象的离子方程式,不正确的是(?)
A.氢氧化钠溶液中滴入紫色石蕊试液,再通入CO2,溶液有蓝变红:CO2+2OH-=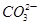 +H2O +H2O
B.漂白粉溶液中加氯化铁溶液产生大量红褐色沉淀:Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO
C.Cl2通入FeBr2溶液中,Cl2与FeBr2物质的量之比4︰5:10Fe2++6Br-+8Cl2=10Fe3++3Br2+16Cl-
D.碳酸氢铵溶液中加足量澄清石灰水: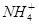 + +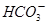 +Ca2++2OH-=CaCO3↓+NH3·H2O+H2O +Ca2++2OH-=CaCO3↓+NH3·H2O+H2O
参考答案:A
本题解析:A选项石蕊试液变红,溶液应生成HCO3-,错误。
本题难度:一般
5、选择题 能正确表示下列反应的离子方程式是
A.Ba(OH)2与MgSO4反应:Mg2+十2OH—= Mg(OH)2↓
B.铜片插入到硝酸银溶液中Cu + Ag+=Cu2+ + Ag
C.硫酸铝溶液与氯化钡溶液混合:Ba2+ 十SO42—=BaSO4↓
D.碳酸钙溶于稀醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑
参考答案:C
本题解析:
A.Ba(OH)2与MgSO4反应:Mg2+?十2OH—?= Mg(OH)2↓?钡离子和硫酸根离子也是要参与反应的;
B.铜片插入到硝酸银溶液中Cu + Ag+=Cu2+ + Ag?电荷不守恒;
C.硫酸铝溶液与氯化钡溶液混合:Ba2+ 十SO42—?=BaSO4↓,正确;
D.碳酸钙溶于稀醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑?醋酸是弱酸,不能拆开。故选C,
点评:对于离子方程式的书写和判断,只有记住以下几点就能解决此类问题:
书写原则问题:
1、强酸、强碱和易溶于水的盐改写成离子的形式,难溶物质、难电离物质、易挥发物质、单质、氧化物、非电解质等均写化学式。
2、微溶物作为反应物,若是澄清溶液拆写为离子,若是悬浊液写为化学式。微溶物作为生成物,一般写为化学式,并标“↓”符号。
3、固体与固体间的反应不能写离子方程式,浓H2SO4、浓H3PO4与固体的反应不能写离子方程式。
4、离子方程式要做到两守恒:原子数目守恒,电荷数目守恒。
5、多元弱酸酸式根离子,在离子方程式中不能拆写。
6、一些特殊反应(如酸式盐与碱的反应、部分复杂的氧化还原反应)要考虑并满足反应物物质的量的比值。
本题难度:一般
|