微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列化合物中,既可与盐酸反应,又可与氢氧化钠溶液反应的是?
A.Al(OH)3
B.Na2CO3
C.FeCl3
D.H2SO4
参考答案:A
本题解析:Al(OH)3为两性氢氧化物,既可与盐酸反应,又可与氢氧化钠溶液反应,符合题意,选A
本题难度:一般
2、选择题 X是第二周期元素,能与氧形成X2O5,则有关X的叙述正确的是
A.X的氢化物在固态属于分子晶体
B.X2O5的水化物是一种非氧化性的酸
C.X的单质在常温下以分子晶体形式存在
D.X所在族元素的单质在固态时属于同一晶体类型
参考答案:A
本题解析:
本题难度:困难
3、填空题 A、B、C、D、E为元素周期表中前三周期元素形成的五种离子,A、B、C、D四种离子的电子数均比E的电子数少8。
(1)A与B结合成的化合物甲中既有离子键又有共价键,A与C结合成的化合物乙难溶于水,乙溶于甲的水溶液得无色透明溶液,C元素在周期表中的位置为______________,乙与甲的水溶液反应的离子方程式为___________________________________。
(2)B与E结合成化合物丙,其中离子数之比为2∶1,A与D结合成化合物丁,丁与丙反应产生无色无味的气体,该反应的化学方程式为_______________________________。
(3)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和甲的水溶液可形成氢氧燃料电池,负极的电极反应为_________________________________,电极反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8?L饮用水时,电池内转移的电子数约为________NA。
(4)有一种液态氮氢化合物戊,分子中氮与氢两种元素的质量比为7∶1,与E的电子数相同,是“神舟七号”飞船发射时使用的高能燃料之一,结构分析发现该分子结构中只有单键,与氨相似,则戊的结构式为_________________________________,1?mol戊与过量盐酸反应的离子方程式是____________________________,戊在氧化还原反应中与H2O2相似,既可作氧化剂,又可作还原剂,根据价态分析产生这种情况的原因_________________________________________________;8?g液态戊与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,放出375?kJ的热量,写出该反应的热化学方程式_______________________________。
参考答案:(1)第三周期第ⅢA族;Al(OH)3+OH-===AlO2-+2H2O
(2)2Na2O2+2H2O===4NaOH+O2↑?
(3)2H2+4OH--4e-===4H2O;200
(4)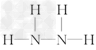 ;N2H4+2H+===N2H62+;戊中氮元素的化合价为-2价,既可以升高,又可以降低;
;N2H4+2H+===N2H62+;戊中氮元素的化合价为-2价,既可以升高,又可以降低;
N2H4(l)+2H2O2(l)===N2(g)+4H2O(g)?ΔH=-1500?kJ/mol
本题解析:
本题难度:一般
4、选择题 1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学发展史上的重要里程碑之一.下列有关我们常用的元素周期表的说法正确的是( )
A.元素周期表有七个横行,也是七个周期
B.元素周期表有18个纵行,即有18个族
C.短周期是指第一、二、三、四周期
D.ⅠA族的元素全部是金属元素
参考答案:A.由元素周期表的结构可知,元素周期表有七个横行,也是七个周期,故A正确;
B.元素周期表有18个纵行,7个主族、7个副族、1个0族、1个第ⅤⅢ族,故B错误;
C.短周期是指第一、二、三周期,而第四周期为长周期,故C错误;
D.ⅠA族的元素包含H及碱金属,H是非金属元素,故D错误;
故选A.
本题解析:
本题难度:简单
5、填空题 (1)某元素最高化合价为+5,原子最外层电子数为2,半径是同族中最小的,其核外电子排布式为
_________,价电子构型为_________,属_________区元素。
(2)某元素原子的价电子构型为4s24p1,它属于第_________周期,_________族,最高正化合价为_________,元素符号是_________。
(3)原子序数为24的元素原子中有_________个电子层,_________个能级,_________个未成对电子。
(4)请写出有2个能层的p轨道中只有一个未成对电子的基态原子的外围电子排布图(有几个写几个)
__________________
参考答案:“略”
本题解析:
本题难度:一般