微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用.请回答下列问题:
(1)32号元素Ge的原子核外电子排布式为______.
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是______.
(3)已知SnO2是离子晶体,写出其主要物理性质______(写出2条即可).
(4)已知:
| CH4 | SiH4 | NH3 | PH3
沸点(K)
101.7
161.2
239.7
185.4
分解温度(K)
873
773
1073
713.2
|
分析上表中四种物质的相关数据,请回答:
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是______.
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是______.
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时______先液化.
参考答案:(1)Ge的原子序数为32,则电子排布式为[Ar]3d104s24p2,故答案为:[Ar]3d104s24p2;
(2)C、Si、Sn随原子序数增大,非金属性减弱,金属性增强,只有Sn为金属,则Sn为金属晶体,故答案为:Sn;
(3)离子晶体熔沸点较高,硬度较大,熔融状态能导电等性质,故答案为:熔沸点较高,硬度较大;
(4)①CH4和SiH4比较,相对分子质量大的沸点高,而NH3和PH3比较,氨气中含有氢键沸点大,
故答案为:CH4和SiH4比较,相对分子质量越大,范德华力越大,故沸点高,而NH3和PH3比较前者分子间存在氢键沸点高;
②由键长越短,键能越大,越稳定,分解温度就越高可知,分解破坏的均为共价键,C-H的键能大于Si-H的键能,N-H键的键能大于P-H键的键能,
故答案为:分解破坏的均为共价键,C-H的键能大于Si-H的键能,N-H键的键能大于P-H键的键能;
一定压强下,沸点高的气体先液化,HF分子之间存在氢键,沸点高,则HF和HCl的混合气体降温时HF先液化,
故答案为:HF.
本题解析:
本题难度:一般
2、填空题 短周期元素X、Y、Z在周期表中位置关系如下图所示。

(1)X元素的单质分子式是_________。若X核内中子数与质子数相等,X单质的摩尔质量是________。
(2)Y单质的电子式是_____________。Y单质与水反应的化学方程式:_______________________。
(3)Z与钙形成的化合物的电子式是_____________。
参考答案:(1)He;4g/mol
(2) ;2F2+2H2O==4HF+O2↑
;2F2+2H2O==4HF+O2↑
(3)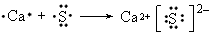
本题解析:
本题难度:一般
3、推断题 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族族序数相等,请回答下列问题:
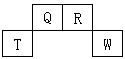
(1)T元素的原子结构示意图为____________,Q元素在元素周期表中的位置为____________,R元素单质的电子式为____________。
(2)原子序数比T少2的元素是____________(填元素符号),用电子式表示该元素与W元素形成化合物的过程________________________。
(3)原子序数比W多4的元素是____________(填元素符号),该元素最高价氧化物的水化物溶液与W元素最高价氧化物的水化物溶液反应的离子方程式为:________________________。
参考答案:(1) ;第二周期ⅣA族;
;第二周期ⅣA族;
(2)Na;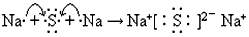
(3)Ca;Ca2++2OH-+2H++SO42-== CaSO4↓+2H2O
本题解析:
本题难度:一般
4、推断题 有A,B,C,D4种元素,A的正二价离子与Ar的电子层结构相同,B有3个电子层,其单质为双原子分子,
c的核外电子比A少1个,D与B在点燃和光照条件下均能化合成一种气体,它溶于水成为强酸。
(1)写出A,B,C,D的离子符号:_______________;
(2)用电子式表示这4种元素的原子形成离子化合物的过程:___________________________。
参考答案:(1)A:Ca2+,B:Cl-,C:K+,D:H+
(2)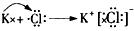 ;
;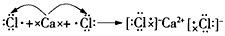
本题解析:
本题难度:一般
5、选择题 有五个系列同族元素的物质,101.3kP时测定它们的沸点(℃)如表所示:
| ① | He-268.8 | (a)-249.5 | Ar-185.8 | Kr?151.7
②
F2-187.0
Cl2-33.6
(b)?58.7
I2?184.0
③
(c)?19.4
HCl-84.0
HBr-67.0
HI-35.3
④
H2O?100.0
H2S-60.0
(d)-42.0
H2Te-1.8
⑤
CH4-161.0
SiH4-112.0
GeH4-90.0
(e)-52.0
|
对应表中内容,下列叙述中不正确的是( )
A.a、b、c的化学式分别为Ne、Br2、HF
B.系列②物质均有氧化性;系列③物质对应水溶液均呈酸性
C.系列④中各化合物的稳定性顺序为:H20>H2S>H2Se>H2Te
D.上表内物质HF和H2O,分子内都存在非极性共价键
参考答案:A、He、Ne、Ar、Kr是同一只族元素的原子,根据递变顺序,可知a为Ne;F、Cl、Br、I属于同一主族元素的原子,且b应是单质形式,即为Br2,c为氢化物,即HF,
则a、b、c的化学式分别为Ne、Br2、HF,故A正确;
B、卤素单质均表现为较强的氧化性,其氢化物的水溶液都表现为酸性,故B正确;
C、O、S、Se、Te的原子的得电子能力越弱,非金属性越来越弱,则氢化物的稳定性越弱,故C正确;
D、HF和H2O,分子内都存在极性共价键,故D错误.
故选D.
本题解析:
本题难度:一般