微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 KClO3与NaHSO3间的氧化还原反应生成Cl-和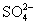 的速率与时间关系如下图,已知反应速率随c(H+)的增加而加快,试说明
的速率与时间关系如下图,已知反应速率随c(H+)的增加而加快,试说明

?(1)为什么反应开始时,反应速率增大?
(2)反应后期,反应速率逐渐降低的主要原因是___________。
参考答案:见解析
本题解析:KClO3与NaHSO3间的氧化还原反应为: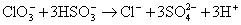 。显然,该反应有H+生成,且随着反应的进行,H+的物质的量浓度会越来越大。所以,反应开始时,反应速率逐渐增大。到了反应后期,
。显然,该反应有H+生成,且随着反应的进行,H+的物质的量浓度会越来越大。所以,反应开始时,反应速率逐渐增大。到了反应后期,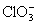 和
和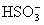 不断消耗,其浓度也就越来越小,反应速率自然也就逐渐降低了。
不断消耗,其浓度也就越来越小,反应速率自然也就逐渐降低了。
本题难度:简单
2、选择题 少量铁粉与100ml?0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O?②加NaOH固体?③滴入几滴浓盐酸?④加CH3COONa固体⑤加NaCl溶液?⑥滴加几滴硫酸铜溶液?⑦升高温度(不考虑盐酸挥发)⑧改用10ml?0.1mol/L的盐酸.
A.①⑥⑦
B.③⑤⑧
C.③⑦⑧
D.③⑥⑦⑧
参考答案:①加水,稀释了盐酸的浓度,故反应速率变慢;
②加氢氧化钠,与盐酸反应,减少了盐酸的浓度,故反应速率变慢;
③加浓盐酸,反应速率加快;
④加醋酸钠固体与盐酸反应生成弱酸醋酸,故反应速率减慢;
⑤加氯化钠溶液,相当于稀释盐酸浓度,故反应速率变慢;
⑥滴加硫酸铜溶液,铁把铜置换出来,形成原电池,故反应速率加快,但与盐酸反应的铁减少,故减少了产生氢气的量;
⑦升高温度,反应速率加快;
⑧改用浓度大的盐酸,反应速率加快.
故选C.
本题解析:
本题难度:简单
3、填空题 Ⅰ.课本中通过向草酸(H2C2O4)溶液中滴加用硫酸酸化高锰酸钾中研究浓度对化学反应速率的影响,请你写出该反应的化学方程式?,该反应不需使用指示剂的原因是?;
Ⅱ.某同学根据课本外界条件对化学反应速率的影响原理,设计了硫代硫酸钠与硫酸反应有关实验,实验过程的数据记录如下(见表格),请结合表中信息,回答有关问题:
实验
序号
| 反应温度
(℃)
| 参加反应的物质
|
Na2S2O3
| H2SO4
| H2O
|
V/mL
| c/mol?L-1
| V/mL
| c/mol?L-1
| V/mL
|
A
| 20
| 10
| 0.1
| 10
| 0.1
| 0
|
B
| 20
| 5
| 0.1
| 10
| 0.1
| 5
|
C
| 20
| 10
| 0.1
| 5
| 0.1
| 5
|
D
| 40
| 5
| 0.1
| 10
| 0.1
| 5
|
?
(1)写出上述反应的离子方程式?
(2)根据你所掌握的知识判断,在上述实验中反应速率最快的可能是?(填实验序号)
(3)在利用比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有?关的各项反应条件.其中:
①能说明温度对该反应速率影响的组合比较是?;(填实验序号)
②A和B、A和C的组合比较所研究的问题是?
③B和C的组合比较所研究的问题是?
(4)教材是利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用排水法测量单位时间内气体体积的大小的可能原因:?
参考答案:Ⅰ、5H2C2O4+3H2S04+2KMnO4=K2SO4+2MnSO4+10CO2+8H2O?高锰酸钾溶液有颜色变化Ⅱ、(1)S2O32-+2H+═S↓+SO2+H2O(2)D(3)①BD②相同温度条件下浓度对该反应速率的影响③相同温度条件下,该反应速率更大程度上取决于哪种反应物的浓度(4)SO2可溶于水,测定不精确或实验装置较复杂,不易控制
本题解析:Ⅰ、向草酸(H2C2O4)溶液中滴加用硫酸酸化高锰酸钾的化学方程式为:5H2C2O4+3H2S04+2KMnO4=K2SO4+2MnSO4+10CO2+8H2O,又因为高锰酸钾溶液随反应的进行有颜色的变化,故该反应不需使用指示剂;Ⅱ、(1)硫代硫酸根离子和氢离子反应生成硫、二氧化硫和水,离子反应方程式为:S2O32-+2H+═S↓+SO2+H2O;(2)温度越高,反应速率越快,浓度越大反应速率越快,在上述实验中反应速率最快的可能是D;(3)①能说明温度对该反应速率影响的组合中两者的温度不同,其它物理量相同,故选BD;②A和B、A和C的组合中不同的物理量是浓度,所以比较所研究的问题是相同温度条件下浓度对该反应速率的影响;?③B和C的组合不同点是:硫代硫酸钠和硫酸的浓度不同,所以比较所研究的问题是相同温度条件下,该反应速率更大程度上取决于哪种反应物的浓度;(4)二氧化硫可以溶于水,1体积水能溶解40体积二氧化硫,所以导致测定不精确,且该实验装置较复杂,不易控制,所以不采用排水法测量单位时间内气体体积的大小进行比较。
本题难度:一般
4、选择题 对于可逆反应:2A(g)+B(g)  2C(g);△H<0,下列各图正确的是
2C(g);△H<0,下列各图正确的是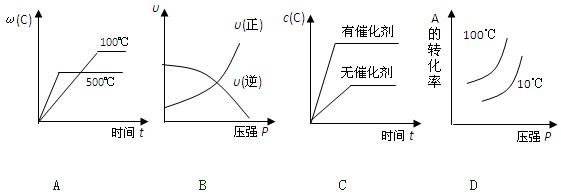
参考答案:A
本题解析:由于反应是放热反应,所以升高温度,反应速率加快,但平衡向逆反应方向移动C的含量降低,A的转化率降低,所以A正确,D不正确。增大压强反应速率都是增大的,B不正确。催化剂不能改变平衡状态,C不正确。答案选A。
本题难度:困难
5、选择题 四个试管中都装有5 mL 0.1 mol·L-1 Na2S2O3溶液,分别在不同温度下加入0.1 mol·L-1硫酸和一定量水,最先出现浑浊的是
A.20 ℃,10 mL硫酸
B.20 ℃,5 mL硫酸和5 mL水
C.30 ℃,10 mL硫酸
D.30 ℃,5 mL硫酸和5 mL水