微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 质量为2.2 g的化合物A含有3.01×1022个A分子,则A的相对分子质量为
A.11
B.22
C.44
D.64
参考答案:C
本题解析:由题意可知,A的摩尔质量为44g/mol,所以A的相对分子质量是44,选C
本题难度:简单
2、选择题 0.5L?0.5mol/L?FeCl3溶液与3L?0.5mol/L?KCl溶液中的Cl-的物质的量浓度之比( )
A.1:6
B.1:1
C.2:1
D.3:1
参考答案:氯化铁溶液中氯离子的物质的量浓度=3×c(?FeCl3)=3×0.5mol/L=1.5mol/L,
氯化钾溶液中氯离子的物质的量浓度=1×c(?KCl)=1×0.5mol/L=0.5mol/L,
所以0.5L?0.5mol/L?FeCl3溶液与3L?0.5mol/L?KCl溶液中的Cl-的物质的量浓度之比为1.5mol/L:0.5mol/L=3:1.
故选D.
本题解析:
本题难度:一般
3、填空题 请完成下列填空:
(1)当SO2和SO3中分子个数比为1∶1 时,原子总数之比为?,质量之比为?。
(2)中和含0.2 mol HCl的稀盐酸,需NaOH的质量为?g。
(3)现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol—1,则:
①该气体的物质的量为?mol。
②该气体在标准状况下的体积为?L。
③该气体溶于水后形成V L溶液(不考虑反应),其溶液的物质的量浓度为?mol·L—1。
(4)将5 mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度是?mol·L—1。
(5)用等体积的0.1 mol·L—1的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液中的SO42—完全沉淀,则三种硫酸盐的物质的量浓度之比为?。
参考答案:(12分)
(1)3∶4? 4∶5?(2)8?(3)①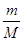 ?②
?②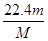 ?③
?③ ?(4)10a/b mol/L?(5)2∶6∶3
?(4)10a/b mol/L?(5)2∶6∶3
本题解析:(1)、设SO2和SO3中分子个数均为x个,则它们所含原子总数之比为(x+2x)∶(x+3x)=3∶4;由于n=N/NA,则它们的物质的量之比为1∶1 ,设均为ymol;由于m=n?M,则它们的质量之比为(64y)∶(80y)=4∶5;(2)、盐酸与氢氧化钠中和反应式为NaOH+HCl=NaCl+H2O,由于两反应物的化学计量数之比等于物质的量之比,则消耗NaOH的物质的量为0.2mol;由于m=n?M,则NaOH的质量为0.2mol×40g/mol=8g;(3)、①由于n=m/M,则该气体的物质的量为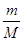 mol;②由于V=n×22.4L/mol,则该气体气体为
mol;②由于V=n×22.4L/mol,则该气体气体为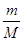 mol×22.4L/mol=
mol×22.4L/mol=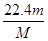 L;③由于c=n/V,则该气体溶解所得溶液中溶质的物质的量浓度为
L;③由于c=n/V,则该气体溶解所得溶液中溶质的物质的量浓度为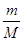 mol÷VL=
mol÷VL= mol/L;(4)由稀释定律可知,稀释前后硝酸镁的物质的量相等,c1?V1=c2?V2,则稀释后硝酸镁的物质的量浓度为5a/bmol/L;硝酸镁的电离方程式为Mg(NO3)2=Mg2++2NO3—,生成物与反应物的化学计量数之比等于物质的量之比,则稀释后硝酸根离子浓度为10a/bmol/L;(5)、沉淀反应式均为Ba2++SO42—=BaSO4↓,两反应物的化学计量数之比等于物质的量之比,由于三反应消耗的氯化钡相同,设Ba2+和SO42—均为xmol;三种可溶性硫酸盐的电离方程式为:Fe2(SO4)3=2Fe3++3SO42—、Na2SO4=2Na++SO42—、KAl(SO4)2=K++Al3++2SO42—,其中反应物和硫酸根离子的化学计量数之比等于物质的量之比,则消耗的Fe2(SO4)3、Na2SO4、KAl(SO4)2分别为x/3mol、xmol、x/2mol;由于三种硫酸盐溶液体积相同,c=n/V,则Fe2(SO4)3、Na2SO4、KAl(SO4)2的物质的量浓度之比为x/3∶x∶x/2=2∶6∶3。
mol/L;(4)由稀释定律可知,稀释前后硝酸镁的物质的量相等,c1?V1=c2?V2,则稀释后硝酸镁的物质的量浓度为5a/bmol/L;硝酸镁的电离方程式为Mg(NO3)2=Mg2++2NO3—,生成物与反应物的化学计量数之比等于物质的量之比,则稀释后硝酸根离子浓度为10a/bmol/L;(5)、沉淀反应式均为Ba2++SO42—=BaSO4↓,两反应物的化学计量数之比等于物质的量之比,由于三反应消耗的氯化钡相同,设Ba2+和SO42—均为xmol;三种可溶性硫酸盐的电离方程式为:Fe2(SO4)3=2Fe3++3SO42—、Na2SO4=2Na++SO42—、KAl(SO4)2=K++Al3++2SO42—,其中反应物和硫酸根离子的化学计量数之比等于物质的量之比,则消耗的Fe2(SO4)3、Na2SO4、KAl(SO4)2分别为x/3mol、xmol、x/2mol;由于三种硫酸盐溶液体积相同,c=n/V,则Fe2(SO4)3、Na2SO4、KAl(SO4)2的物质的量浓度之比为x/3∶x∶x/2=2∶6∶3。
本题难度:一般
4、实验题 (1)用18?mol/L硫酸配制100?mL?1.0?mol/L硫酸。若实验仪器有:A.100?mL量筒、B.托盘天平、C.玻璃棒、D.50?mL容量瓶、E.10?mL量筒、F.胶头滴管、G.50?mL烧杯、H.100?mL容量瓶。实验时选用仪器的先后顺序是________(填?写编号)。
(2)在容量瓶的使用方法中,下列操作不正确的是________(填写标号)。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试?样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2?cm处,用胶头滴管加蒸馏水到标线
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2?cm处,用胶头滴管滴加蒸馏水到标线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次
参考答案:(1)GECHF或EGCHF
(2)BCD
本题解析:
本题难度:一般
5、选择题 已知气体的密度与它的摩尔质量成正比。一只气球若放在空气(空气的平均摩尔质量是29 g·mol-1)中可静止不动,那么在相同条件下该气球放在下列气体中会下沉的是
A.O2
B.Cl2
C.CO2
D.CH4