微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式书写正确的是(?)
A.铝粉投入到NaOH溶液中:2Al+2OH-+2H2O══ 2AlO2—+3H2↑
B.AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓
C.三氯化铁溶液中加入铁粉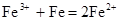
D.FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
参考答案:AD
本题解析:B中氨水是难电离的,应该用化学式表示,B不正确;C中没有配平,应该是2Fe3++Fe=3Fe2+,C不正确,其余选项都是正确的,答案选AD。
点评:该题是高考中的高频题,属于中等难度的试题,侧重对学生能力的培养和训练。该题需要明确判断离子方程式正确与否的方法一般,即(1)检查反应能否发生。(2)检查反应物、生成物是否正确。(3)检查各物质拆分是否正确。(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等)。(5)检查是否符合原化学方程式,然后灵活运用即可。该题有助于培养学生分析问题、解决问题的能力。
本题难度:简单
2、选择题 下列离子方程式中正确的是?
A.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42- = BaSO4↓+H2O
B.Ca(HCO3)2与过量Ca(OH)2溶液反应:
Ca2++HCO3-+2OH- = CaCO3↓+CO32-+2H2O
C.N a2CO3溶液中通入少量CO2: CO32-+CO2+H2O = 2HCO3-
a2CO3溶液中通入少量CO2: CO32-+CO2+H2O = 2HCO3-
D.CH3COOH溶液与NaOH溶液反应: H++OH- = H2O
参考答案:C
本题解析:略
本题难度:简单
3、填空题 (1)某一反应体系中有反应物和生成物共5种物质:S、H2S 、HNO3、NO 、H2O;则该反应中还原产物是_____;若反应过程中转移了0.3mol电子,则氧化产物的质量是_____g。
(2)将a mol Cl2通入含b mol FeBr2的溶液中,当0< a / b≤1/2 时,反应的离子方程式为:
2Fe2+ + Cl2 = 2Fe3+ + 2Cl-,写出另2个可能发生的离子方程式。
①当 a / b =1时?;
②当a / b≥3/2时?。
(3)观察如下反应,总结规律,然后完成下列问题:
①Al(OH)3+H2O  Al(OH)4-+ H+ ?;② Cl2+2OH-= Cl-+ ClO-+H2O
Al(OH)4-+ H+ ?;② Cl2+2OH-= Cl-+ ClO-+H2O
(Ⅰ)已知B(OH)3是一元弱酸,试写出其电离方程式:?;
(Ⅱ)单质氰(CN)2是类卤素,试写出其与氢氧化钠溶液反应的离子方程式?。
参考答案:(1)NO(2分)?, 4.8g? (2分)
(2) ①2Cl2 + 2Fe2+ + 2Br― = 2Fe3+ + Br2 + 4Cl―? (3分)
②3Cl2 + 2Fe2+ + 4Br― = 2Fe3+ + 2Br2 + 6Cl― (3分)?
(3)(Ⅰ)B(OH)3+H2O  ?B(OH)4― + H+? (2分)
?B(OH)4― + H+? (2分)
(Ⅱ)(CN)2 +2OH― = CN― + CNO― +H2O? (2分)
本题解析:(1)硝酸的氧化性大于硫,所以在该反应中硝酸作氧化剂,在反应中得电子N化合价降低被还原,还原产物是NO,硫化氢在反应中失电子被氧化S化合价降低生成硫单质,所以该反应的方程式为:3H2S+2HNO3=3S+2NO+4H2O,当生成3molS时,反应转移电子的物质的量是6mol,则若反应过程中转移了0.3mol电子,则反应生成的S是0.15mol,所以质量为32g/mol×0.15mol=4.8g。
(2)FeBr2的溶液中,还原性Fe2+ >Br― ,所以通入氯气,Fe2+?先被氯气氧化,反应完后再通氯气,Br― 被氧化。所以当0< a / b≤1/2时,只有Fe2+ 被氧化,所以发生反应2Fe2+ + Cl2 = 2Fe3+ + 2Cl- ;当 a / b =1时,Fe2+?全部被氧化,Br― 是Fe2+?的2倍,只有1半被氧化,所以发生的反应方程式为2Cl2 + 2Fe2+ + 2Br― = 2Fe3+ + Br2 + 4Cl― ;当a / b≥3/2时,Fe2+?、Br―全部被氧化,所以反应为3Cl2 + 2Fe2+ + 4Br― = 2Fe3+ + 2Br2 + 6Cl―。
(3)因为B(OH)3是一元弱酸,所以类似氢氧化铝(偏铝酸)的电离:Al(OH)3+H2O  Al(OH)4-+ H+ ?,所以B(OH)3 应该是与水作用,也生成酸根离子:B(OH)3+H2O
Al(OH)4-+ H+ ?,所以B(OH)3 应该是与水作用,也生成酸根离子:B(OH)3+H2O  ?B(OH)4― + H+ ;单质氰(CN)2是类卤素,其性质与卤素单质类似,所以其与氢氧化钠溶液反应也应该生成两种盐,把CN看成一个卤素原子,则成盐离子为CN-、CNO- ,所以离子方程式为:(CN)2 +2OH― = CN― + CNO― +H2O。
?B(OH)4― + H+ ;单质氰(CN)2是类卤素,其性质与卤素单质类似,所以其与氢氧化钠溶液反应也应该生成两种盐,把CN看成一个卤素原子,则成盐离子为CN-、CNO- ,所以离子方程式为:(CN)2 +2OH― = CN― + CNO― +H2O。
本题难度:一般
4、选择题 下列解释物质用途或现象的反应方程式不准确的是
A.硫酸型酸雨的形成会涉及反应:2H2SO3+O2 2H2SO4
2H2SO4
B.热的纯碱溶液可以清洗油污的原因: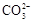 +2H2O
+2H2O H2CO3+2OH?
H2CO3+2OH?
C.盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH?=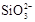 +H2O
+H2O
D.成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl?+ ClO?+2H+= Cl2↑+ H2O
参考答案:B
本题解析:热的纯碱溶液可以清洗油污的原因是碳酸根离子水解使溶液显碱性,多元弱酸阴离子水解分布进行,第一步只生成碳酸氢根离子,故B不正确;其余都正确,故选B。
本题难度:一般
5、选择题 下列离子方程式正确的是( )
A.金属钠与水反应:Na+2H2O=Na++2OH-+H2↑
B.Ag2S沉淀溶解平衡表达式:Ag2S?2Ag++S2-
C.Fe3O4与稀硝酸溶液反应:2Fe3O4+18H+=6Fe3++H2↑+8H2O
D.NaHCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
参考答案:A.金属钠与水反应的离子反应为2Na+2H2O=2Na++2OH-+H2↑,故A错误;
B.Ag2S沉淀溶解平衡表达式:Ag2S(s)?2Ag+(aq)+S2-(aq),故B错误;
C.Fe3O4与稀硝酸溶液反应的离子反应为3Fe3O4+NO3-+28H+=9Fe3++NO↑+14H2O,故C错误;
D.NaHCO3溶液与足量Ba(OH)2溶液混合的离子反应为HCO3-+Ba2++OH-=BaCO3↓+H2O,故D正确;
故选D.
本题解析:
本题难度:简单