微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列对SO3的说法中正确的是
[? ]
A.结构与NH3相似
B.结构与SO2相似
C.结构与BF3相似
D.结构与P4相似
参考答案:C
本题解析:
本题难度:简单
2、填空题 C60以其完美的球形结构受到科学家的高度重视,从此掀起了球形分子的研究热潮。继C60后,科学家又合成了Si60、N60等球形分子。
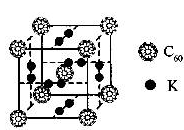
(1)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体.该物质的K原子和C60分子的个数比为?
(2)Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为?
(3)写试出C60、Si60、N60熔点由高到低的顺序为?,破坏这三种分子所需要的能量顺序为??
参考答案:(1)3:1? (2)30? (3) Si60>N60> C60、?N60>C60>Si60
本题解析:(1)根据晶胞可知,K原子的个数是6×1/2=3个,而C60分子的个数8×1/8=1个,所以该物质的K原子和C60分子的个数比为3:1。
(2)根据题意,每个硅形成的这3个键中,必然有1个双键,这样每个硅原子最外层才满足8电子稳定结构。显然,双键数应该是Si原子数的一半,而每个双键有1个π键,显然π键数目为30。
(3) C60、Si60、N60形成的晶体都是分子晶体,熔点高低和相对分子质量大小有关系,所以熔点高到低的顺序为Si60>N60> C60。破坏这三种分子需要破坏共价键,所以所需要的能量顺序为N60>C60>Si60。
点评:该题是高考中的常见题型和考点,属于中等难度试题的考查,试题综合性强,侧重对学生能力的培养和训练,有利于培养学生的逻辑推理能力、自学能力和知识的迁移能力,提高学生灵活运用基础知识解决实际问题的能力。
本题难度:一般
3、填空题 单质硼有无定形和晶体两种,参考下表数据
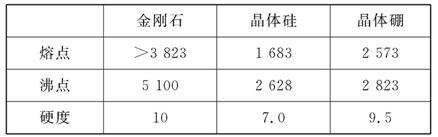
晶体硼的晶体类型属于?晶体,理由是?
参考答案:(1)原子?晶体的熔、沸点和硬度都介于晶体硅和金刚石之间,而金刚石和晶体硅均为原子晶体
本题解析:根据表中数据可知,晶体硼的熔、沸点和硬度都介于晶体硅和金刚石之间,而金刚石和晶体硅均为原子晶体,所以晶体硼的晶体类型是原子晶体。
点评:该题是常识性知识的考查,侧重对学生基础知识的培养和训练,有利于培养学生的自学能力和知识的迁移能力,有助于提升学生的学科素养。
本题难度:简单
4、填空题 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。其中A原子核外有三个未成对电子;化 合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
(1)A的简单氢化物分子中其中心原子采取________杂化,E的最高价氧化物分子的空间构型是____________。
(2)B的氯化物的熔点比D的氯化物的熔点________(填高或低),理由是_____________.
(3)A、B、C、D的第一电离能由小到大的顺序为
_________________。(用元素符号表示)?
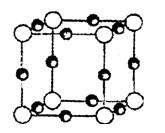
(4)A、F形成某种化合物的晶胞结构如右图所示(其中A显-3价),则其化学式为____________;(每个球均表示1个原子)
(5)F的价电子轨道表示式是______________,A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,则其化学式为______________________。
参考答案:
本题解析:略
本题难度:一般
5、填空题 (15分)A、B、C、D、E、F六种元素,A、B、C属于第四周期元素且单质均为固体,原子处于基态时A、B原子核外电子均成对,且核电荷数A>B;C与A在周期表属于同一区的元素,如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E、F的原子均有三个能层,E原子的第一至第四电离能(kj/mol)分别为:578、1817、2745、ll575;E与F能形成原子数目比为1:3、熔点为190℃的化合物Q
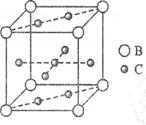
(1)写出A的基态核外电子排布式?;用最简式表示B、C形成合金的组成
?(用B、C元素符号表示)。该合金的密度为 a g/cm3,其晶胞的边长为?。
(2)C2+和A2+都能与NH3、H20等形成配位数为4的配合物。[A(NH3)4]2+和[C(NH3)4]2+空间构型不同且都具有对称性,则[C(NH3)4]2+的空间构型为?。[A(NH3)4]2+中A原子轨道的杂化方式为?。
(3) 含有D、碳、硫三种元素的负一价离子中,所有原子均满足最外层8电子结构,一个电子是由硫原子所得,则其电子式为?。
(4)实验测得气态无水Q在1.Ol×105 Pa、t1℃的密度为5.OO g·L-1、气体摩尔体积为53.4 L·mol-,则此时Q的组成为(写化学式)?,
参考答案:(1)1s22s22p63s23p63d104s2或[Ar]3d104s2?CaCu5?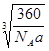 cm(3分)?(2)平面正方形? sp3?(3)
cm(3分)?(2)平面正方形? sp3?(3)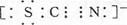 ? (4)A12C16
? (4)A12C16
本题解析:根据A、B原子核外电子均成对,且核电荷数A>B,所以A是锌,B是钙。C与A在周期表属于同一区的元素,且二者位于同一周期,所以C是铜。D原子在基态时p轨道半充满且电负性是同族元素中最大的,所以D是氮元素。EF属于第三周期,根据E的电离能可知,E是铝元素。E与F能形成原子数目比为1:3、熔点为190℃的化合物Q,所以F是氯元素。
(1)根据晶胞的结构图可知,含有的钙原子数是8×1/8=1,铜原子是8×1/2+1=5,所以化学式为CaCu5。设边长为x,则x3×a g/cm3=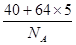 ,解得x=
,解得x=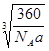 cm。
cm。
(2)[A(NH3)4]2+和[C(NH3)4]2+空间构型不同且都具有对称性,说明[C(NH3)4]2+的空间构型是平面正方形,[A(NH3)4]2+是正四面体型结构,所以是sp3杂化。
(3)所有原子均满足最外层8电子结构,所以氮和碳形成的是三键,因此电子数为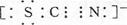 。
。
(4)根据密度和气体的摩尔体积可知,Q的相对分子质量是53.4×5.00=267,所以化学式为A12C16。
本题难度:一般