微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (共12分)
(1)以CO2为碳源制取低碳有机物一直是化学领域的研究热点,CO2加氢制取低碳醇的反应如下:
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-49.0kJ/mol
反应II:2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O(g) △H=-173.6kJ/mol
写出由CH3OH(g)合成CH3CH2OH(g)的反应的热化学方程式_______________
(2)高铁酸钾(K2FeO4)是铁的一种重要化合物,具有极强的氧化性
①电解法是工业上制备K2FeO4的一种方法。以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH。电解时阳极发生反应生成FeO42-,该电极反应式为_________________
②与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作正极材料,其电极反应式为FeO42-+3e-+4H2O=Fe(OH)3+5OH-,则该电池总反应的离子方程式为__________________
(3)amol FeS与bmol FeO投入到VL、C mol/L的硝酸溶液中充分反应产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为_____
①(a+b)×63g?②(a+b)×189g?③(a+b)mol?④VC-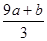 mol
mol
参考答案:(1)2CH3OH(g)=CH3CH2OH(g)+H2O(g) △H= -75.6kJ/mol
(2)①Fe-6e- +8OH- = FeO42- + 4H2O
②3Zn + 2FeO42- + 8H2O = 2Fe(OH)3 + 3Zn(OH)2 + 4OH-
(3)②④
本题解析:(1)盖斯定律:不管化学反应是一步完成或分几步完成,其反应热相同。故有
2CH3OH(g)+2H2O(g) =2CO2(g)+6H2(g)?△H=-98.0kJ/mol?①
2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O(g) △H=-173.6kJ/mol?②
①+②得2CH3OH(g)=CH3CH2OH(g)+H2O(g) △H= -75.6kJ/mol
(2)电解池中,电池正极连接的电极叫做阳极,发生氧化反应,负极连接的电极叫做阴极,发生还原反应。
①此题以铁为阳极,电解氢氧化钠溶液,生成FeO42-,故电极方程式为
Fe-6e- +8OH- = FeO42- + 4H2O
②在K2FeO4—Zn碱性电池中,正极得电子被还原,其电极反应式为
FeO42-+3e-+4H2O=Fe(OH)3+5OH-,负极Zn被氧化,
其电极反应式为:Zn-2e-+2OH-=Zn(OH)2,将两极得失电子数守恒后合并可得总反应式:2FeO42-+8H2O+3Zn=2Fe(OH)3+3Zn(OH)2+4OH-。
(3)反应中硝酸有两个作用,一是做氧化剂被还原成NO气体。二是起酸的作用生成硝酸铁,这一部分硝酸根化合价没变化,没有被还原。所以根据反应前亚铁离子总量即可知道反应后硝酸铁总量,进一步就知道了没被还原的硝酸的量。反应前有a mol FeS与b mol FeO ,根据铁原子守恒知道反应后Fe(NO3)3的物质的量是(a+b)mol,那么里面硝酸根的物质的量是3(a+b)mol,即有3(a+b)mol硝酸没有被还原,其质量是
 ,②正确。
,②正确。
另外可以从得失电子角度考虑。
FeS被氧化为硝酸铁和硫酸,铁升高1价,硫升高8价,所以a mol FeS反应中失去电子9amol。FeO被氧化为硝酸铁,铁升高1价,所以b mol FeO 反应中失去电子bmol。
失去的电子被硝酸根得到,硝酸根还原成NO,氮元素化合价降低3价,根据得失电子守恒知道,被还原的硝酸的物质的量是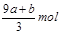 mol又因为硝酸总量是n==CVmol,所以未被还原的硝酸的物质的量是
mol又因为硝酸总量是n==CVmol,所以未被还原的硝酸的物质的量是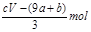 ,④答案正确。
,④答案正确。
点评:本题考出学生对盖斯定律的理解掌握,在答题过程中要注意符号的书写以及有效数字
的保留问题;电解池原理,要求学生掌握相关的电极方程式和总的方程式;第三小题,需要
学生理解硝酸在反应中的应用。
本题难度:一般
2、选择题 炎热的夏季里,能喝上一口冰镇饮料是非常惬意的事情。目前,一种人称“摇摇冰”的即冷即用饮料已经上市。所谓“摇摇冰”,是指吸食前将饮料隔离层中的制冷物质和水混合摇动能使罐中饮料冷却。若该制冷物质可以在下列物质中选择,它应该是(? )。
A.氯化钠
B.固体硝酸铵
C.固体氧化钠
D.固体氢氧化钠
参考答案:B
本题解析:氯化钠溶于水时,溶液温度没有明显的变化;强酸、强碱溶于水时放出大量的热;强酸或中强酸对应的氧化物,如SO3、P2O5等与水反应时,也放出大量的热;强碱或中强碱对应的碱性氧化物,如Na2O、CaO与水反应时,也放出大量的热;硝酸铵溶于水时,吸收大量的热而使溶液的温度明显降低。
本题难度:一般
3、选择题 下列说法不正确的是
A.焦炭在高温下与水蒸气的反应是吸热反应
B.氢氧化钾与硝酸的反应是放热反应
C.燃料有足够的空气就能充分燃烧
D.化学反应的过程,都可以看成是“贮存”在物质内部的能量转化为热能等而被释放出来的过程
参考答案:CD
本题解析:略
本题难度:简单
4、填空题 (10分)化学在生活中有很多的应用,如臭氧可用于空气净化、饮用水消毒、工业废物处理和作为漂白剂等,氮化硅(Si3N4)是一种新型陶瓷材料,具有较高的硬度且耐高温。
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。已知: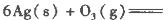
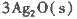 反应生成3 mol Ag2O(s)时放出的热量为
反应生成3 mol Ag2O(s)时放出的热量为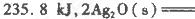
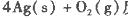 反应生成4 mol Ag(s)时吸收的热量为62.2 kJ,试根据题给数据判断O3转化为O2是________(填“放热”或“吸热”)反应。
反应生成4 mol Ag(s)时吸收的热量为62.2 kJ,试根据题给数据判断O3转化为O2是________(填“放热”或“吸热”)反应。
(2)氮化硅()可由石英与焦炭在高温的氯气流中通过如下反应制得:
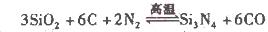
在VL的密闭容器中进行反应,实验数据如下表:
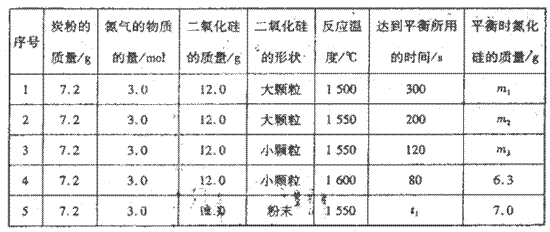
①实验l和实验2表明,________对反应速率有影响,对同一规律研究的实验还有一组是________(填实验序号)。本实验还研究了_______对反应速率的影响。。
②实验5中,t1________(填“>”、“<”或“=”)120,平衡时,二氧化硅的转化率为____________________。
参考答案:(1)放热
(2)①温度;实验3和实验4;反应物的形状;
②<;41.7%
本题解析:(1)根据题目所给信息,结合盖斯定律判断臭氧转化为氧气2O3(g)=3O2(g)的△H=-235.8 kJ/mol×2+62.2 kJ/mol×3=-285kJ/mol<0,所以该反应是放热反应;
(2)① 实验l和实验2的不同之处在于温度的不同,所以实验l和实验2表明温度对反应速率有影响;对同一规律研究的实验还有一组是实验3和实验4,只是温度不同,其他均相同;通过分析表中数据,其他条件相同而二氧化硅的形状不同,反应速率也不同,所以本实验还研究了反应物的形状对反应速率的影响;
②实验5与实验3相比,只是二氧化硅的形状不同,其余条件均相同,反应物的表面积越大,反应速率越快,粉末状比小颗粒的表面积大,所以t1<120;二氧化硅的初始量是12.0g,平衡时的质量是7.0g,所以消耗5.0g,二氧化硅的转化率是5.0g/12.0g×100%=41.7%。
本题难度:一般
5、选择题 已知298 K时,合成氨反应N2(g)+3H2(g)  2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失) (? )?
2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失) (? )?
A.一定小于92.0 kJ
B.一定大于92.0 kJ
C.一定等于92.0 kJ
D.无法确定
参考答案:A
本题解析:N2和H2反应生成NH3的反应为可逆反应,可逆反应不能完全进行到底,反应物的转化率不能达到100%.N2和H2反应生成NH3的反应为可逆反应,反应为:N2+3H2 2NH3,可逆反应不能完全进行到底,反应物的转化率不能达到100%,此温度下的1molN2和3molH2放在一密闭容器中,不能生成2molNH3,则反应放出的热量小于92.0kJ,故选A.
2NH3,可逆反应不能完全进行到底,反应物的转化率不能达到100%,此温度下的1molN2和3molH2放在一密闭容器中,不能生成2molNH3,则反应放出的热量小于92.0kJ,故选A.
本题难度:一般